-
生产生活中处处有化学,化学是人类进步的关键。下列表述错误的是
A. 汽车排放的尾气和冬季取暖排放的颗粒污染物是形成雾霾的一个因素
B. 泡沫灭火器中用的是小苏打和硫酸铝
C. 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,1.12 L戊烷所含共价键数目为0.8NA
B. 1 L 0.1 mol/L (NH4)2SO4溶液中含N原子数为0.2NA
C. 2.2 g D218O与T2O的混合物中所含质子数、中子数均为NA
D. 25 mL 16 mol·L-1浓硫酸与13 g锌共热,转移的电子数小于0.4NA
难度: 中等查看答案及解析
-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。对下列反应实验现象的推断或解释正确的是
选项
操作
实验现象
解释
A
向某钾盐中滴加浓盐酸,产生气体再通入品红溶液
品红溶液褪色
该钾盐为K2SO3或KHSO3
B
铝热剂溶于足量稀盐酸再滴加KSCN溶液
出现血红色
铝热剂中一定含有氧化铁
C
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置
下层液体呈紫色
氧化性:Br2>I2
D
将足量过氧化钠固体投入紫色石蕊试液中
溶液变成蓝色
过氧化钠与水反应生成氢氧化钠,溶液呈碱性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
W、X、Y、Z是原子半径依次增大的四种短周期主族元素,已知25℃时,W、X形成的0.1 mol/L化合物的水溶液pH=1,Z的电子层数与最外层电子数相等。下列说法错误的是
A. X、Y、Z一定位于同一周期
B. X与Y形成的化合物中各原子不一定达到8电子稳定结构
C. Y、Z的最高价氧化物对应水化物之间一定能相互反应
D. W与X、Y形成的化合物的稳定性一定是前者大于后者
难度: 困难查看答案及解析
-
咖啡酸具有较广泛的抑菌作用,结构简式为
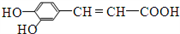 。下列有关说法中正确的是
。下列有关说法中正确的是A. 分子中含有四种官能团
B. 可以用酸性高锰酸钾溶液检验碳碳双键
C. 1 mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1∶2
D. 1 mol咖啡酸可与4 mol Br2发生反应
难度: 中等查看答案及解析
-
某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是
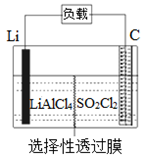
A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e−=2Cl−+SO2↑
难度: 困难查看答案及解析
-
某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
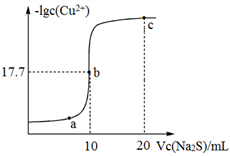
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 mol•L-1的混合溶液中逐滴加入10-4 mol•L-1的Na2S溶液,Zn2+先沉淀
难度: 困难查看答案及解析
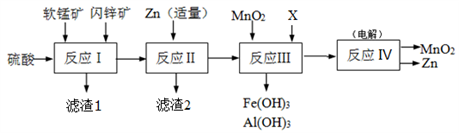
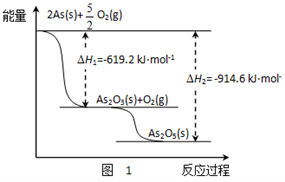
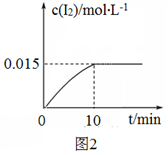
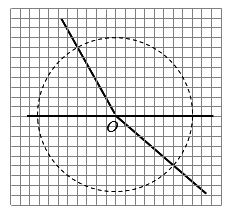
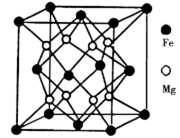
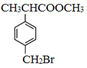 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下: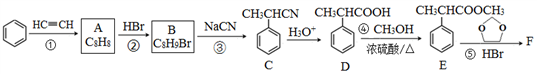
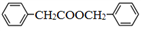 的合成路线___________________________。
的合成路线___________________________。