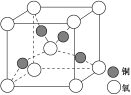
-
化学知识在工农业生产和日常生活中应用广泛。下列有关说法不正确的是
A.金属钠着火时可用水扑灭
B.中秋月饼包装盒内常放入小袋生石灰作为干燥剂
C.铜质水龙头与铁质水管连接处容易发生电化学腐蚀导致生锈
D.盐碱地(含较多的NaCl、Na2CO3等)中施加适量石膏可降低土壤的碱性
难度: 中等查看答案及解析
-
分子式为C5H11Br且含有两个甲基的同分异构体共有(不考虑立体结构)
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质)。下列分析不正确的是

A.电子由Ag电极经外电路流向Pt电极
B.空气中c(Cl2)越大,Ag极消耗速率越快
C.正极反应:Cl2+2e-+2Ag+ === 2AgCl
D.原电池工作时电解质中Ag+数目减少
难度: 中等查看答案及解析
-
下列说法正确的是
A.NaHSO4溶液中,c(Na+) +c(H+) = c(SO42-) + c(OH-)
B.室温时水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存
C.等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>①
D.在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
难度: 困难查看答案及解析
-
A~H元素在元素周期表中的相对位置如下表。A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素。下列判断正确的是
A
E
B
F
C
D
…
H
G
A.原子半径:H>F>E
B.金属性:A>B>D
C.C与G的原子核外电子数相差3
D.B的单质在空气中燃烧生成只含离子键的化合物
难度: 中等查看答案及解析
-
下图是检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色。据此判断,气体X和液体Y可能是

选项
物质
A
B
C
D
X
H2S
SO2
CO2
Cl2
Y
浓硫酸
NaHCO3饱和溶液
Na2SO3
溶液
NaHSO3
溶液
难度: 中等查看答案及解析
-
绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡。已知EGCG的结构简式如图,下列有关说法错误的是

A.EGCG的分子式为C22H18O11
B.1mol EGCG最多可与含9mol NaOH的溶液反应
C.EGCG在空气中易被氧化,不能与溴水发生加成反应
D.EGCG不能与Na2CO3溶液反应
难度: 中等查看答案及解析