-
关于合金的叙述:①合金中至少含两种金属;②合金中的元素以化合物的形式存在;③合金中一定含金属;④合金一定是混合物。其中正确的是
A.①②③④ B.①③④ C.②③④ D.③④
难度: 简单查看答案及解析
-
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 中等查看答案及解析
-
对某酸性溶液(可能含有Br-、SO42—、H2SO3、NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
A.Br- B.SO42— C.H2SO3 D.NH4+
难度: 中等查看答案及解析
-
下列溶液中:①石灰水 ②Na2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
A.②④⑤ B.①② C.①②⑤ D.只有①
难度: 中等查看答案及解析
-
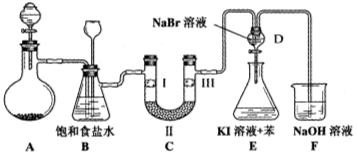
下图是一种试验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
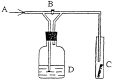
A.浓H2SO4 B.饱和Na2CO3溶液
C.浓NaOH溶液 D.饱和NaCl溶液
难度: 中等查看答案及解析
-
同温同压下,在3支体积不同的试管中分别充满等体积混合的2种气体,它们是:①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中溶质的物质的量浓度分别为c1、c2、c3(假设溶质全在试管中),则下列关系正确的是
A.c1>c2>c3 B.c1>c3>c2 C.c1=c3>c2 D.c1=c2>c3
难度: 中等查看答案及解析
-
向一定量的FeO、Fe、Fe2O3的混合物中加入100ml1mol/L的盐酸,恰好使混合物完全溶解,放出224ml标况下的气体,在所得溶液中滴入硫氰化钾溶液无血红色出现(即无3价铁)。若用足量CO在高温下还原同质量的此混合物,能得到铁的质量是
A、11.2g B、5.6g C、2.8g D、无法计算
难度: 中等查看答案及解析
-
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+ D.只有Fe2+
难度: 中等查看答案及解析
-
将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为

难度: 中等查看答案及解析
-
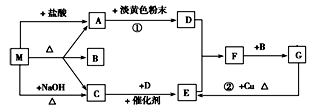
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是
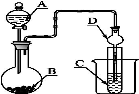
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
难度: 中等查看答案及解析
-
类推是学习和研究的重要思维方法。下列类推结论正确的是
化学事实
类推结论
A
Al在O2中燃烧生成Al2O3
Fe在O2中燃烧也生成Fe2O3
B
pH=3的盐酸稀释1000倍后pH=6
pH=6的盐酸稀释1000倍后pH=9
C
用电解熔融MgCl2的方法冶炼金属镁
用电解熔融NaCl的方法制取金属钠
D
将SO2通入BaCl2溶液中无沉淀生成
将SO2通入Ba(NO3)2溶液中也无沉淀生成
难度: 中等查看答案及解析
-
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是
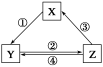
选项
X
Y
Z
箭头上所标数字的反应条件
A
CaO
Ca(OH)2
CaCO3
①常温遇水
B
AlCl3
NaAlO2
Al(OH)3
②通入CO2
C
Na2CO3
NaOH
NaHCO3
④过量Ca(OH)2溶液
D
Cl2
Ca(ClO)2
HClO
③加浓盐酸
难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是:
选项
A
B
C
D
X
C
Fe
Ca(OH)2溶液
AlCl3
W
O2
HNO3
CO2
NH3·H2O
难度: 中等查看答案及解析
-
以下物质间的转化通过一步反应不能实现的是
①.HCl →Cl2→HClO→NaClO ②.Na→Na2O2→Na2CO3→NaHCO3
③.Al→NaAlO2 →Al(OH)3→Al2O3 ④.Si→SiO2→H2SiO3→Na2SiO3
⑤.S→SO3→H2SO4→Na2SO4 ⑥.Cu →CuCl2→Cu(OH)2
A.②③ B.④⑤ C.③④⑤⑥ D.①④⑤
难度: 中等查看答案及解析
-
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3—
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42—、HCO3—
C.c(Fe3+)=0.1mol·L-1的溶液:H+、Al3+、I-、SCN-
D.常温下pH=12的溶液:Na+、K+、SiO32—、NO3—
难度: 中等查看答案及解析
-
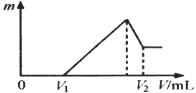
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42—、CO32—等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
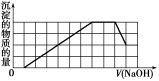
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C.原溶液中一定含有SO42—和Na+
D.反应最后形成的溶液中溶质只有Na2SO4
难度: 中等查看答案及解析