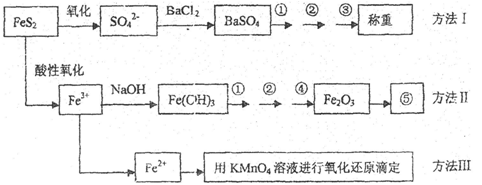
-
下列物质的水溶液能导电,但属于非电解质的是
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
难度: 简单查看答案及解析
-
在19世纪,化学家对氧化锆的化学式有争议。经测定,锆的相对原子质量为91,其氯化物的相对分子质量是233。若氧化锆中锆的化合价与氯化物中的相同,试判断氧化锆的化学式为
A.ZrO2 B.Zr2O C.Zr2O3 D.ZrO
难度: 简单查看答案及解析
-
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60 互为同素异形体
C.14N与15N互为同位素 D. 15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
在氧化还原反应3S + 6KOH = K2SO3 + 2K2S + 3H2O中,被氧化和被还原的硫原子数之比为
A.1 :2 B.2 :1 C.1 :1 D.3 :2
难度: 简单查看答案及解析
-
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是

A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
难度: 简单查看答案及解析
-
能鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是
A.HNO3 B.KOH C.BaCl2 D.NaClO
难度: 简单查看答案及解析
-
下列叙述正确的是
A.CO和CaO分别属于酸性氧化物和碱性氧化物
B.根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸等
C.蒸馏和蒸发分别可以从海水中得到淡水和粗盐
D.石油和水银分别属于纯净物和混合物
难度: 简单查看答案及解析
-
有关氯化铁溶液与氢氧化铁胶体的性质的叙述中错误的是
A.加入烧碱溶液均有沉淀析出 B.前者稳定而透明,而后者不稳定又不透明
C.只有一者有丁达尔现象 D.都能透过滤纸
难度: 简单查看答案及解析
-
下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是
A.K+、MnO4–、Cl–、SO42– B.Na+、I–、NO3–、CO32–
C.Na+、H+、NO3–、SO42– D.Na+、Ag+、NO3–、I–
难度: 简单查看答案及解析
-
若NA代表阿伏加德罗常数,下列说法正确的是
A.常温常压下,32gO2和O3的混合气体所含原子数小于2 NA
B.常温常压下,2.24L Cl2与足量的Mg充分反应,转移的电子数目小于0.2NA
C.18g重水(D2O)含有10NA个电子
D.标准状况下,2.24L苯(分子式C6H6)完全燃烧得到的CO2分子数为0.6NA
难度: 简单查看答案及解析
-
以下实验装置一般不用于分离物质的是
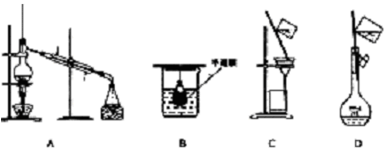
难度: 简单查看答案及解析
-
下列实验设计和结论相等的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.某无色溶液中加入稀盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,则原溶液中一定有CO32-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. 等体积、等浓度的Ca(HCO3)2溶液与NaOH溶液混合
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性
2H++SO42—+2OH—+Ba2+=2 H2O+BaSO4↓
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
难度: 简单查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是 A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2+O2+2H2O D.2Fe2++Cl2=2Fe3++2 Cl -
难度: 简单查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
难度: 简单查看答案及解析
-
把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
难度: 简单查看答案及解析
-
金属钾的冶炼可采用如下两种方法,方法一:K2CO3 + 2C
2K↑+ 3CO↑,
方法二:2KF + CaC2
CaF2 + 2K↑+ 2C。下列有关说法合理的是
A.方法一中碳元素只被氧
B.方法二CaC2中碳的化合价为+1
C.方法二中氧化剂和还原剂的物质的量之比为2∶1
D.两种方法中,当生成相同物质的量的K时,转移的电子数相同
难度: 简单查看答案及解析
-
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是
A.ρ = (17V + 22400) / (22.4 + 22.4V) B.ω = 17c / (1000ρ)
C.ω = 17V / (17V + 22400) D.c = 1000Vρ / (17V + 22400)
难度: 简单查看答案及解析
-
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化
Fe3+ → Fe2+ MnO4— → Mn2+ Cl2 → Cl— HNO2 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4— C.Cl2 D.HNO2
难度: 简单查看答案及解析
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Cl-、Mg2+、Ba2+、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.K+可能存在 B.100 mL溶液中含0.01 mol CO32 -
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
难度: 简单查看答案及解析