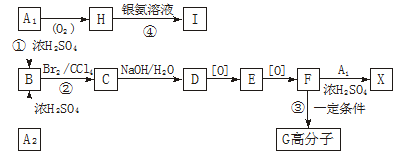
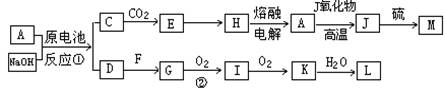
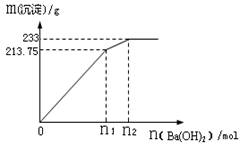
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.滴入甲基橙显红色的溶液中: Na+、NO3-、I-、SO42-
B.水电离出的c(H+) =10-12mol/L中:K+、AlO2-、CH3COO-、SiO32-
C.c(OH-)/c(H+)=1012的水溶液中:K+、ClO-、S2-、Cl-
D.c(F-) =0.1 mol/L的溶液中:Fe3+、NH4+、NO3-、Cu2+
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:
4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,7.8 g苯中含有单键的数目为0.9 NA
B.标准状况下,14g氮气含有的核外电子数为5 NA
C.标准状况下,2.24 L H2与O2的混合物中含有的分子数为0.1 NA
D.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氧原子数为0.3 NA
难度: 中等查看答案及解析
-
下列化学用语的理解正确的是( )
A.离子结构示意图
:可以表示35Cl-,也可以表示37Cl-
B.电子式
:可以表示羟基,也可以表示氢氧根离子
C.比例模型
:可以表示甲烷分子,也可以表示四氯化碳分子
D.结构简式(CH3)2CHOH:可以表示1–丙醇,也可以表示2–丙醇
难度: 简单查看答案及解析
-
已知质量分数为98%的浓硫酸的物质的量浓度为18.4 mol·L-1,则物质的量浓度为9.2 mol·L-1的硫酸溶液的质量分数为( )
A.49% B.小于49% C.大于49% D.无法确定
难度: 简单查看答案及解析
-
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等。下列说法正确的是( )
A.元素Q的非金属性比R的强
B.离子半径的大小顺序为:r(Tm+)>r(Wn—)
C.元素Q的氧化物均为酸性氧化物
D.元素T与元素R的最高正价之和等于8
难度: 简单查看答案及解析
-
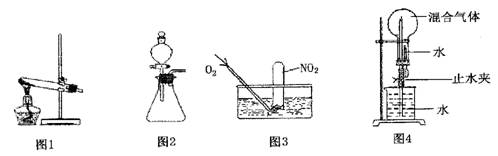
下列有关实验原理或实验操作正确的是( )

A.用干燥pH试纸测定某新制氯水的pH
B.用图1装置能除去乙烷中混有的乙烯
C.用图2装置能验证HCl气体在水中的溶解性
D.用25 mL碱式滴定管量取20.00 mLKMnO4 溶液
难度: 简单查看答案及解析
-
亚氨基羟(Li2NH)是一种储氢容量器,是安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是( )
A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
难度: 简单查看答案及解析
-
2011年2月15日,备受全球关注的苹果股份有限公司,发布了长达25页的《2011年供应商责任进展报告》,首次承认此前发生中毒事件的联建科技和运恒五金是其供应商,以及这两家工厂违规使用有毒原料对工人造成的危害的事实。据了解此次中毒事件的“杀手”是一种分子式为C6H14的有机物。已知C6H14有多种同分异构体,则其同分异构体中沸点最高的分子的一氯取代物的种数是( )
A.2 B.3 C.4 D.5
难度: 简单查看答案及解析
-
若某共价化合物分子中只含有C、N、H三种元素,且以n(C)、n(N)分别表示C、N的原子数目,则H原子数目最多等于
A .2n(C)+2+n(N) B.2n(C)+2+2n(N) C.2n(C)+2 D .2n(C)+1+2n(N)
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH-
CH2ClCOO-+H2O
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O → 2C6H5OH+CO32-
D.用银氨溶液检验乙醛中的醛基:
CH3CHO +2[Ag(NH3)2]+ + 2OH-
CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O
难度: 简单查看答案及解析
-
下列有机物的名称正确的是
A.2,2-二甲基-3-戊烯 B.4,5-二甲基-3 -乙基己烷
C.2,3-二甲基-4 -乙基己烷 D.2,3,3-三甲基丁烷
难度: 简单查看答案及解析
-
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图所示。关于“亮菌甲素”的说法中,正确的是
A.“亮菌甲素”可以与乙酸发生酯化反应
B.“亮菌甲素”的分子式为C12H12O5
C.1 mol“亮菌甲素”最多能和2 mol NaOH反应
D.1 mol“亮菌甲素”最多能和4 mol H2发生加成反应
难度: 简单查看答案及解析
-
2007年10月,一台湾女孩因食用河虾后服用大剂量的维生素C而中毒。菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是
A. 在该反应中维生素C作催化剂
B. 因为河虾中含有砷元素,所以不能食用
C. 砒霜是砷的氧化物,由上述可推知砒霜中含有的砷是+3价
D. 上述反应中维生素C作氧化剂
难度: 简单查看答案及解析
-
α-鸢尾酮香料的分子结构如图,下列说法不正确的是
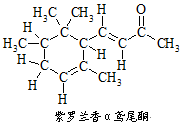
A.α-鸢尾酮可与某种酚互为同分异构体
B.1 mol α-鸢尾酮最多可与3molH2加成
C.α-鸢尾酮经加氢→消去→加氢三步反应可转变为
D.α-鸢尾酮能发生银镜反应
难度: 简单查看答案及解析
-
现在为婴儿特制成一种新型的尿布——“尿不湿”。这种尿布表面涂有一种既能吸水又能保留水的物质。据你的推测,这种特殊物质的结构可能是
A.
B.
C.
D.
难度: 简单查看答案及解析