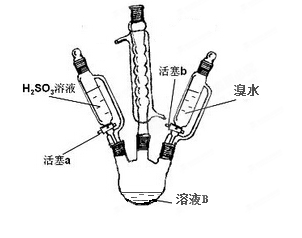
-
化学与生活、生产有密切联系,下列说法正确的是
A.为防止食品氧化变质,在包装袋中加入硫酸铁粉末
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.酸雨不能马上用来浇花,应静置1-2个小时再使用
D.不同材料混合在一起即为复合材料
难度: 中等查看答案及解析
-
我市南海新区道路两边矗立着太阳能路灯(如图所示),下列说法错误的是
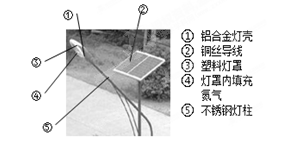
A.此路灯可以减少环境的污染,减少碳的排放
B.①②⑤属于金属材料,③属于有机合成材料
C.制造太阳能电池板的主要材料是二氧化硅
D.太阳能电池还可应用于道路边上的各种用电的指示标志牌等设备
难度: 中等查看答案及解析
-
分类是学习和研究化学物质的一种常用的科学方法,下列分类正确的是
A.硫酸氢钠能解离出H+,与碳酸钠反应有二氧化碳生成,因此属于酸
B.氨气溶于水显碱性,但氨气不属于碱,NH3·H2O属于碱
C.SiO2既能与氢氟酸反应又能与氢氧化钠溶液反应,因此属于两性氧化物
D.常温下铜能够导电,但不是在熔融状态和水溶液中,因此属于非电解质
难度: 中等查看答案及解析
-
下列关于溶液和胶体的叙述,正确的是
A.向胶体中加入电解质溶液,能发生聚沉
B.溶液呈电中性的,胶体是带电的
C.溶液能透过滤纸,胶体不能透过滤纸
D.溶液和胶体的本质区别是能否发生丁达尔现象
难度: 中等查看答案及解析
-
国际能源网报道:金属燃料可能成为新能源,可能带来结束煤、石油能源时代的希望,是一种理想的储能方式,下列说法错误的是
A.金属燃烧后经加工处理后还可生成金属,因此可以重复使用
B.金属燃烧产生的光能,可以通过相关设备转化为电能以充分利用
C.镁、铝是地球上含量丰富的金属元素,且均可以从海水中提取
D.可以利用镁在二氧化碳中燃烧,放出热量的同时收集碳单质
难度: 中等查看答案及解析
-
下列关于物质性质的叙述正确的是
A.氧化钠和过氧化钠含有相同的元素,与水反应的产物也相同
B.CO2与SiO2的组成相同,两者的化学性质也相同
C.铁和铜都属于金属,久置在潮湿的空气中均生成金属氧化物
D.H2O2和Na2O2都有强氧化性,两者均能使品红溶液褪色
难度: 中等查看答案及解析
-
下列实验不能达到目的的是
A.用湿润红色石蕊试纸检验氨气
B.用湿润的淀粉-KI试纸检验氯气
C.向浓盐酸中滴加浓硫酸获得少量HCl气体
D.用加热的方法除去氯化铵中的碘
难度: 中等查看答案及解析
-
在水溶液中能大量共存的一组离子是
A.NH4+、Na+、NO3-、SO42- B.H+、Fe2+、SO42-、NO3-
C.H+、Mg2+、SiO32-、SO42- D.H+、Al3+、ClO-、Cl-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.0.1 mol·L-1 Na2S溶液中含有0.2 NA个Na+
B.标准状况下,22.4 L 的H2O含有2NA个氢原子
C.常温下,44 g CO2含有NA个氧原子
D.0.1 mol Na与足量O2反应生成Na2O,转移0.1 NA个电子
难度: 中等查看答案及解析
-
下列有关单质及其氧化物的说法正确的是
A.铜和铁与硫在加热条件下反应分别生成硫化亚铜和硫化铁
B.铁与氧化铝组成的铝热剂,可用来焊接钢轨
C.酸性氧化物均为非金属氧化物,均能与水反应生成相应的酸
D.氯气、硫、二氧化氮与氢氧化钠溶液反应时既作氧化剂又作还原剂
难度: 中等查看答案及解析
-
下列陈述I、II正确并且有因果关系的是
选项
陈述I
陈述II
A
SO2和氯气都能使品红褪色
两者都有漂白性
B
Al(OH)3是两性氢氧化物
盐酸和氨水能溶解Al(OH)3
C
镁能与氮气发生反应
镁是活泼金属,有较强的还原性
D
氯化氢气体不导电,盐酸导电
两者都属于电解质
难度: 中等查看答案及解析
-
已知磷单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是
A.该反应中P做还原剂,H2O作氧化剂
B.该反应中氧化产物和还原产物的物质的量比为1:3
C.每有1mol P参加反应,转移0.75mol电子
D.该反应每转移0.3mol电子,就有2.24L PH3气体生成
难度: 中等查看答案及解析
-
下列实验操作或装置(略去部分加持仪器)正确的是
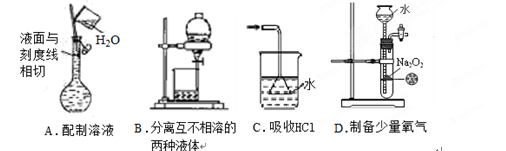
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al+2OH-+6H2O=2[ Al(OH)4] -+3H2↑
B.NaHCO3电离:NaHCO3
Na++ H++CO32-
C.醋酸与碳酸钠反应:2H++CO32-= CO2↑+H2O
D.铜与氯化铁溶液反应:Fe3+ + Cu = Cu2+ + Fe2+
难度: 中等查看答案及解析
-
下列甲、乙两组反应,生成气体的物质的量相等的是
选项
甲
乙
A
1mol碳与足量浓硫酸反应源
1mol铜与足量浓硫酸反应
B
1mol铁与足量稀硝酸反应
1mol铝与足量稀硝酸反应
C
27铝与足量氢氧化钠溶液反应
24g镁与足量盐酸反应
D
1L 12mol/L浓盐酸与足量MnO2反应
1L 12mol/L浓盐酸与足量KMnO4反应
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质(可以是溶液)中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。同下列物质不符合此转化关系的是
A.甲为铁,丁为氯气
B.甲为碳酸钠,丁为盐酸
C.甲为碳,乙为一氧化碳
D.甲为氯气,丁为铁
难度: 中等查看答案及解析
-
相同条件下Al3+比Mg2+更易与OH-反应生成沉淀。现向浓度均为0.1 mol/L的MgCl2和AlCl3混合溶液中,逐滴加入NaOH溶液,下列示意图表示生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系,合理的是

难度: 中等查看答案及解析
-
120 mL浓度为0.1mol / L的FeSO4溶液,恰好与20 mL浓度为0.1 mol / L的K2X2O7溶液完全反应,则元素X在被还原的产物中的化合价是
A.0 B.+2 C.+3 D.+6
难度: 中等查看答案及解析