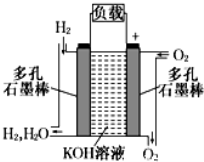
-
下列各组物质中化学键的类型相同的是( )
A.HCl、MgCl2、NH4Cl
B.H2O、Na2O、CO2
C.CaCl2、NaOH、H2O
D.NH3、H2O、CO2
难度: 简单查看答案及解析
-
关于化学能与热能的叙述,正确的是( )
A. 需要加热才能发生的反应,一定是吸热反应
B. 1mol酸与碱恰好中和时所放出的热量叫中和热
C. 化学反应中的能量变化都表现为热量的变化
D. 化学反应中的能量变化,主要是由化学键的变化引起的
难度: 中等查看答案及解析
-
对
与
两种微粒,下列叙述正确的是( )
A. 一定都是由质子、中子、电子组成的
B. 质子数一定相同,质量数和中子数一定不相同
C. 核电荷数和核外电子数一定相等
D. 化学性质几乎完全相同
难度: 简单查看答案及解析
-
以下有关原子结构、元素周期律以及元素周期表的叙述正确的是( )
A. 第ⅠA族元素从上到下,单质的熔点逐渐降低
B. 多电子原子中,在离核较近的区域内运动的电子能量较低
C. 所有主族元素原子的最外层电子数都等于元素的最高正化合价
D. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1L 0.1mol/L的氨水中有0.1NA个NH4+
B. 17 g H2O2中含有8NA个电子
C. 7.8g Na2S和7.8g Na2O2所含离子数相等,均为0.3 NA
D. 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是( )
选项
实验操作
现象
解释或结论
A
稀HNO3中加入过量的Fe 粉,充分反应后,滴入KSCN 溶液
溶液呈红色
稀HNO3将Fe 氧化为Fe3+
B
某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水
有白色沉淀出现
该钾盐是K2CO3
C
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
D
Al 箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密了氧化膜
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
O2和O3是氧元素的两种结构不同的单质,1mol O2转化为O3时要吸收94.73 kJ的热能。下列说法正确的是( )
A. O3比O2稳定
B. O2和O3是氧的两种核素,互称同素异形体
C. O2和O3的相互转化是化学变化
D. 在标准状况下,等体积的O2和O3含有相同数目的氧原子
难度: 中等查看答案及解析
-
下列关于氢化物的叙述正确的是( )
A. 沸点:H2S>HF B. 稳定性:H2S<HF
C. 一个D2O分子中所含的中子数为8 D. HCl的电子式为H+[︰
︰]-
难度: 中等查看答案及解析
-
关于右图所示装置的叙述,错误的是( )

A. 锌是负极,随着放电的进行其质量逐渐减轻
B. 放电过程中氢离子移向铜极,硫酸根离子移向锌极
C. 电流从锌极经导线流向铜极
D. 锌极上发生的是氧化反应,铜极上发生的是还原反应
难度: 简单查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是( )
A. PCl5 B. BF3 C. NCl3 D. CHCl3
难度: 简单查看答案及解析
-
根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是
A. CO和N2 B. O3和NO2- C. N2H4和C2H4 D. CO2和N2O
难度: 中等查看答案及解析
-
原子序数依次相差1,且由小到大排列的A、B、C、D、E五种短周期元素。下列是有关这五种元素的叙述,其中正确的是( )
①若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
②若D的最高价氧化物对应水化物是强酸,则E的单质在常温下为气态
③若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
④若A的最高价氧化物对应水化物是强碱,则E的最高价氧化物对应水化物是强酸
A. ①②③ B. ②③④ C. ③④ D. ②④
难度: 中等查看答案及解析
-
下列关于金属性、非金属性强弱判断不正确的是( )
A. 高温下C + SiO2 = 2CO +Si,说明非金属性C﹥Si
B. 同浓度下碱性:KOH﹥Mg(OH)2,说明金属性K﹥Mg
C. 氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性F﹥Cl
D. 氧化性:Cu2+﹥Na+,说明金属性Na﹥Cu
难度: 简单查看答案及解析
-
某原电池总反应的离子方程式是Fe + 2Fe3+ =3Fe2+,该原电池的组成正确的是( )
Zn
A
B
C
D
正极
Fe
C(石墨)
Ag
Zn
负极
Cu
Fe
Fe
Fe
电解质溶液
FeCl3
Fe2 (SO4)3
H2SO4
FeCl3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知A、B、C、D、E五种短周期主族元素,原子序数依次增大,其中A与C、B与D分别同主族,且B原子的最外层电子数等于A与C原子序数之和的一半。下列叙述正确的是( )
A. 原子半径:A<B<C<D<E
B. D、E的气态氢化物的热稳定性:D>E
C. C与另外四种元素能够分别形成单原子核阴离子的离子化合物
D. A与B、C与B均能形成X2Y2型化合物,且其中所含有的化学键类型相同
难度: 简单查看答案及解析
-
以下对粒子结构或性质的叙述正确的是( )
A. 两种微粒,若核外电子排布完全相同,则化学性质一定相同
B. 由单原子形成的离子,一定具有稀有气体元素原子核外电子排布
C. 阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同
D. 两原子,如果核外电子排布相同,则一定属于同一种元素
难度: 中等查看答案及解析
-
“生物质”是指由植物或动物生命体衍生得到的物质的总称。作为人类解决能源危机重要途径之一的“生物质能”,主要指用树木、庄稼、草类等植物直接或间接提供的能量。下列说法不正确的是( )
A. 生物质能源是可再生的能源
B. 生物质能来源于太阳能
C. 使用沼气作为能源是利用生物质能的一种方式
D. 生物质能的缺点是严重污染环境
难度: 简单查看答案及解析