-
下列说法正确的是 ( )
A.活化分子间所发生的碰撞为有效碰撞
B.增大反应物浓度可增大单位体积内活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大
难度: 中等查看答案及解析
-
下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是( )
A.对水加热到100℃,测得pH=6 B.在水中滴入稀硫酸
C.在水中加入小苏打 D.在水中加入氯化铝固体
难度: 中等查看答案及解析
-
在溶液导电性实验装置里在相同温度下分别注入20 mL 6mol·L-1醋酸和20 mL6mol·L-1氨水,灯光明暗程度相同,如果把这两种溶液混和后再试验则( )
A.灯光变暗;二者电离常数相同 B.灯光变暗;电离常数醋酸大于氨水
C.灯光变亮;电离常数醋酸小于氨水 D.灯光变亮;电离常数醋酸等于氨水
难度: 中等查看答案及解析
-
在密闭容器中发生反应a X(气)+b Y(气)
c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是( )
A.平衡向正反应方向移动 B.a+b>c+d
C.W的体积分数增大 D.X的转化率降低
难度: 困难查看答案及解析
-
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol ,下列说法正确的是( )
A.2L氯化氢气体分解成1L的氢气和1L的氯气,吸收183kJ热量
B.1mol氢气与1mol氯气反应生成2mol液态氯化氢放出的热量小于183kJ
C.在相同条件下,1mol氢气与1mol氯气的能量总和大于2mol氯化氢气体的能量
D.1个氢气分子与1个氯气分子反应生成2个氯化氢分子放出183kJ热量
难度: 中等查看答案及解析
-
已知:①2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1
②2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1 452kJ•mol﹣1
③H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6 kJ•mol﹣1
B.H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+H2O(l)△H=﹣57.3 kJ•mol﹣1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol﹣1
难度: 中等查看答案及解析
-
可逆反应:2SO2(g)+O2(g)
2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内消耗n mol SO2的同时,生成n mol SO2
②单位时间内消耗2n mol SO2的同时,生成n mol O2
③用SO2、O2 、SO3的物质的量浓度变化表示的反应速率的比为2:1:2的状态
④混合气体的密度不再改变的状态
A.①② B.①②④ C.①③④ D.②③④
难度: 中等查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.焓变和熵变都与反应的自发性有关,因此焓变或熵变均可单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系均正确的是( )
操作和现象
结论
A
处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解
Ksp:CaCO3<CaSO4
B
用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成
该电极为阳极
C
向FeCl3和CuCl2混合溶液中加入少量铁粉,有红色固体析出
氧化性:Cu2+<Fe3+
D
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
该溶液中一定含有Ag+
难度: 困难查看答案及解析
-
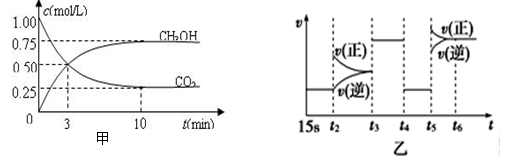
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)⇌2C(g)。容器的反应温度、反应物起始量如下左表,反应过程中C的浓度随时间变化关系如右图表示:下列说法正确的是( )
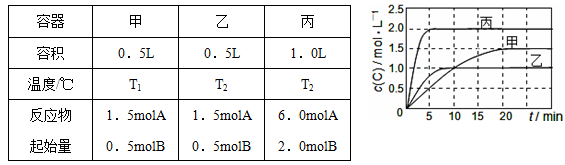
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L•min)
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75%
难度: 困难查看答案及解析
-
下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是( )
A.0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
难度: 困难查看答案及解析
-
下列说法正确的是( )
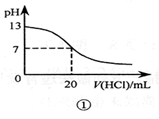
A.泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里。
B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14
D.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
难度: 困难查看答案及解析
-
下列与金属腐蚀有关的说法,正确的是( )
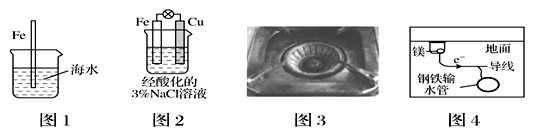
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,发生吸氧腐蚀
C.图3中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极
难度: 中等查看答案及解析
-
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是( )
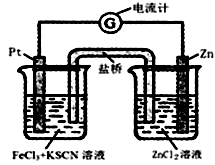
A.正极反应为:Zn – 2e-→Zn2+
B.盐桥中K+向右池移动
C.Pt电极上有气泡出现
D.左烧杯中溶液的红色变浅
难度: 中等查看答案及解析
-
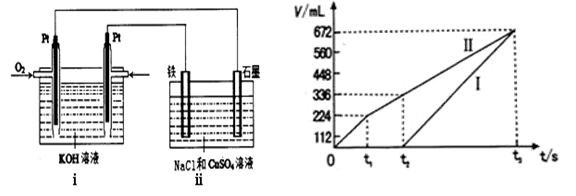
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
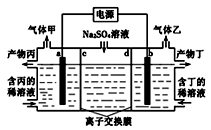
A.a极与电源的负极相连
B.a电极反应式:2H2O+2e-= H2↑+2OH-
C.离子交换膜d为阴离子交换膜
D.产物丙为硫酸溶液
难度: 困难查看答案及解析