-
针对近一时期来我省部分地区发生的多起燃气事故和我市的几起燃气泄漏险情,市公用事业与房产局、市煤气总公司等多个部门和单位联合推出了安全使用燃气宣传周活动(5月28日-6月3日),倡导市民“关爱生命,安全使用燃气”。假如你在家中发现燃气(煤气或液化气等)泄漏,你首先应该做的是
A.立即关闭煤气阀门 B.立即打开排风扇
C.立即在家打电话通知煤气管理所 D.用明火查找漏气部位
难度: 中等查看答案及解析
-
用pH试纸测定某无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.1.0L 1.0mol·L -1的NaAlO2水溶液中含
有的氧原子数为2NA
B.常温常压下,23gNO2中所含的氧原子数为0.5NA
C.常温常压下,11.2LCl2与足量Fe反应,转移电子数为NA
D.1mol的羟基与1mol的氢氧根离子所含质子数均为9NA
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.稀盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与硝酸铜溶液反应:2Na+Cu2+=Cu+2Na+
C.KHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.醋酸钠水【解析】
CH3COO-+H2OCH3COOH+OH-
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7
C.若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则
NaOH溶液的pH=11
D.1.0×10-3mol·L-1盐酸的pH=3.0;1.0×10-8mol·L-1盐酸的pH=8.0
难度: 中等查看答案及解析
-
下列关于溶液酸碱性的说法正确的是( )
A.pH=7的溶液呈中性 B.中性溶液中一定有c(H+)=10-7mol/L
C.c(H+)=c(OH-)的溶液呈中性 D.在100℃时,纯水的pH<7,因此呈酸性
难度: 中等查看答案及解析
-
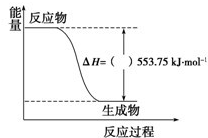
在密闭容器中发生如下反应:mA(g)+nB(s)
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.5倍,下列说法错误的是( )
A.m+n<p B.平衡向左反应方向移动
C.B的转化率降低 D.A的体积分数增加
难度: 中等查看答案及解析
-
下列操作或仪器的选用正确的( )
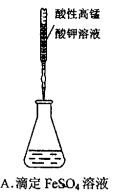

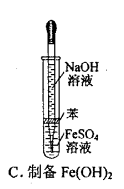

难度: 中等查看答案及解析
-
将浓度为0.1mol•L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(F-) B.Ka(HF) C.
D.
难度: 中等查看答案及解析
-
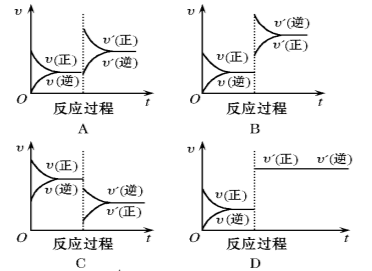
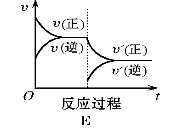
对于可逆反应:2A(g)+B(g)
2C(g) △H>0,下列各图中正确的是( )
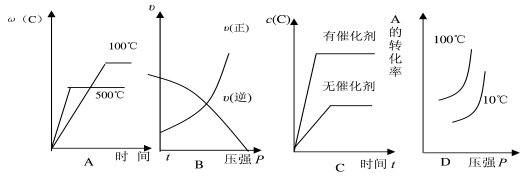
难度: 困难查看答案及解析