-
用括号内试剂除去下列各物质中的少量杂质,正确的是
A.溴苯中的溴(KI溶液)
B.乙烷中的乙烯(KMnO4酸性溶液)
C.乙酸乙酯中的乙酸(饱和Na2CO3溶液)
D.苯中的甲苯(溴水)
难度: 中等查看答案及解析
-
下列金属中在常温下不溶于浓硝酸的是
A.锌 B.镁 C.铝 D.铜
难度: 中等查看答案及解析
-
光导纤维的主要成分是
A.纯硅 B.玻璃 C. SiO2 D. 沙子
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A.钠与水反应 Na + H+ =Na+ + H2
B.用碳酸氢钠作为抗酸药来中和胃酸 H+ + HCO3— = H2O + CO2↑
C.用熟石灰来中和酸性废水 Ca(OH)2 + H+ = Ca2+ + 2H2O
D.用H2SO4来中和碱性废水 2H+ + 2OH— = H2O
难度: 中等查看答案及解析
-
某工厂的废渣中混有少量的锌粉和氧化铜(其它成分不跟酸反应),跟废盐酸接触形成污水。若向该污水中撒入铁粉,反应后铁粉有剩余,所得溶液中一定含有的金属离子是
A.Fe2+、Cu2+ B.Cu2+、Zn2+ C.Zn2+、Fe2+ D.Zn2+、Fe3+
难度: 中等查看答案及解析
-
下列家庭化学小实验不能达到预期目的的是
A.用米汤检验食用加碘盐(含KIO3)中含有碘元素
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用碘酒检验汽油中是否含有不饱和烃
D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
难度: 中等查看答案及解析
-
导致下列现象的主要原因与排放SO2有关的是
A.光化学烟雾 B.酸雨 C.臭氧空洞 D.温室效应
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.1mol NaHSO4晶体含有2NA个离子
B.1L2mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA个
C.1mol CH3+(碳正离子)中含有的电子数为10NA
D.在O2参与的反应中,1molO2 作氧化剂时得到的电子数一定是4NA
难度: 困难查看答案及解析
-
有关下图及实验的描述正确的是( )
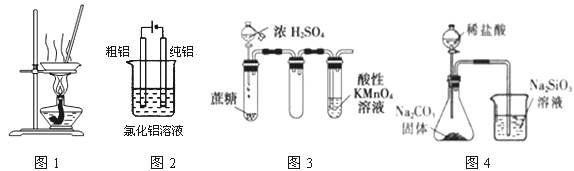
A. 用图1装置蒸发FeCl3溶液制备无水FeCl3
B. 用图2装置精炼铝
C. 用图3装置证明浓硫酸具有脱水性和强氧化性
D. 用图4装置可比较氯、碳、硅三种元素的非金属性强弱
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18克的D216O中含有的中子数为9NA
B.标准状况下,22.4LSO3含有的原子数为4NA
C.80ml10mol/L盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA
D.精炼铜过程中,阳极质量减少6.4g时,电路中转移电子为0.2 NA
难度: 困难查看答案及解析
-
烯烃或炔烃在酸性高锰酸钾溶液作用下,分子中的不饱和键完全断裂,此法可用于减短碳链或利用产物反推不饱和烃的结构等。已知烯烃与酸性 KMnO4溶液反应的氧化产物的对应关系为
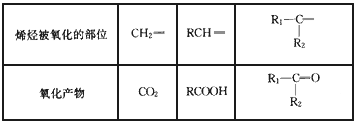
现有某烯烃与酸性KMnO4溶液作用后得到的氧化产物有CO2、乙二酸(HOOC-COOH)和丙酮 (
),则该烯烃结构简式可能是
A.
B.
C. CH2=CH-CH=CHCH2CH3
D.
难度: 困难查看答案及解析
-
1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的微粒,互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列微粒中,不互为等电子体的是
A.N2 和 CO B.CO2 和 N2O C.O3 和 CO2 D.CO32- 和 NO3-
难度: 中等查看答案及解析
-
镁—次氯酸盐燃料电池的工作原理如图所示,该电池反应为Mg+ClO-+H2O=Mg(OH)2+Cl-下列有关说法正确的是

A.电池工作时,c溶液中的溶质是MgCl2
B.电池工作时,正极a附近的pH将不断增大
C.负极反应式:ClO--2e-+H2O=Cl-+2OH-
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
难度: 简单查看答案及解析
-
关于如图所示的氢氧燃料电池的说法错误的是( )

A.电极a是负极
B.电极a上的电极反应为2H2-4e-=4H+
C.外电路中电子由电极a流向电极b
D.氢氧燃料电池的优点是高效、对环境友好
难度: 简单查看答案及解析
-
在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,反应:2A(g)+B(g)
3 C(g)+D(s)不能表明已达平衡状态的是( )
A.B的体积分数
B.气体平均相对分子质量
C.气体的总压强
D.混合气体的密度
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 氯化铵受热固体消失和干冰升华只需克服分子间作用力
B. NaF、H2SO4中所含化学键类型相同
C. HCl气体溶于水和NaOH熔化破坏的化学键类型相同
D. I2、Br2、Cl2、F2熔沸点逐渐降低
难度: 简单查看答案及解析
-
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。下列有关说法正确的是
A. X与Y只能形成一种化合物
B. 最高价氧化物对应水化物的碱性: Y>Z
C. 气态氢化物的热稳定性:M>N
D. 单质的氧化性:X<M
难度: 简单查看答案及解析
-
已知拆开1mol H–H键, 1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H2
2NH3中,每生成2mol NH3,
A.放出92 kJ热量 B.吸收92 kJ热量
C.放出209kJ热量 D.吸收209kJ热量
难度: 简单查看答案及解析
-
对于达到平衡状态的可逆反应:N2 +3H2
2NH3 ,下列有关叙述正确的是
A.N2和NH3的质量分数相等
B.N2 、H2 、NH3的浓度之比为1:3:2
C.当断开1mol氮氮三键的同时,断开3mol氢氢键
D.氮气的体积分数保持不变。
难度: 中等查看答案及解析
-
在一密闭容器中充入1 mol H2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)
2HI(g) 下列说法正确的是( )
A.保持容器容积不变,向其中加入1molI2,化学反应速率不变
B.保持容器容积不变,向其中加入1molHe,化学反应速率增大
C.保持容器内气体压强不变,向其中加入1 mol H2(g)和1molI2(g),化学反应速率不变
D.保持容器内气体压强不变,向其中加入1molHe,化学反应速率不变
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是
A. 离子半径:Na+>Mg2+>Al3+>F—
B. 热稳定性:HCl>H2S>PH3
C. 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4
D. 熔点:SiO2>NaCl>Na>CO2
难度: 中等查看答案及解析
-
中学化学二氧化锰常作催化剂和氧化剂,在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是
A.3%H2O2溶液
B.0.1mol•L-1 NaOH 溶液
C.0.1 mol/LKClO3 溶液
D.0.1 mol/L盐酸
难度: 中等查看答案及解析
-
下表各组物质之间通过一步反应就能实现如图所示转化的是
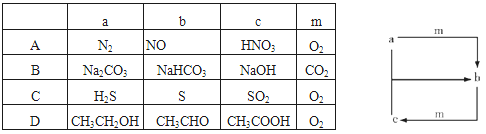
难度: 中等查看答案及解析
-
用下图所示装置检验生成气体时,不能达到目的的是
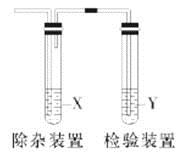
选项
生成的气体
试剂X
试剂Y
A
电石与水反应制取的乙炔
CuSO4溶液
溴水
B
木炭与浓H2SO4加热得到的二氧化碳
饱和NaHCO3溶液
澄清石灰水
C
CH3CH2Br与NaOH醇溶液共热得到的乙烯
水
KMnO4酸性溶液
D
C2H5OH与浓H2SO4加热至170℃制取的乙烯
NaOH溶液
溴水
难度: 简单查看答案及解析
-
仅用下图装置可完成
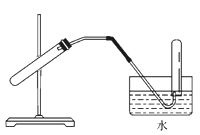
A.浓硫酸和铜制SO2
B.用Cu与浓HNO3反应制NO2
C.用 NH4CI 与 Ca(OH)反应制 NH3
D.用锌粒与稀H2SO4反应制H2
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.用过量石灰乳吸收工业尾气中的SO2: Ca2+ +2OH- +SO2=CaSO3 ↓+ H2O
B.用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2=2Mn2++5O2 ↑+8H2O
C.用铜做电极电解NaCl溶液:2C1—+2H2O
H2↑+Cl2↑+2OH-
D.将 Fe2O3 加入到 HI 溶液中:Fe2O3 + 6H+=2Fe3+ +3H2O
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A.4.6 g NO2与N2O4的混合气体中所含氮原子数为0.1NA
B.常温常压下1.6 g甲烷所含共用电子对数为0.1NA
C.标准状况下,6.72 L CO2与足量Na2O2反应转移电子数为0.6NA
D.50 mL 98%浓硫酸(密度为1.84 g•cm-3)与足量铜共热,转移的电子数为 0.92NA
难度: 困难查看答案及解析
-
下列说法正确的是
A.可使用溴水鉴别植物油和汽油
B.利用二氧化碳制造全降解塑料,可以消除温室效应
C.“玉兔号”月球车上的太阳能电池的材料是硅
D.实验室金属钠失火时,可使用泡沫灭火器灭火
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀H2SO4反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2反应
D.甲烷在O2中的燃烧反应
难度: 简单查看答案及解析
-
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 molL-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 mol·L-1
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
难度: 简单查看答案及解析