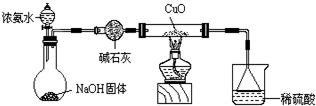
-
在一定条件下,对于密闭容器中进行的可逆反应:N2(g)+3H2(g)⇌2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
A.N2、H2、NH3在密闭容器中共存
B.N2、H2、NH3的浓度不再变化
C.N2、H2、NH3的浓度相等
D.正、逆反应速率都等于零难度: 中等查看答案及解析
-
与铂同族的贵金属钯(Pd)有多种同位素.下列关于46103Pd、46104Pd的说法正确的是( )
A.质子数相同,互称为同位素
B.中子数相同,化学性质不同
C.核外电子数相同,是同一种核素
D.质量数不同,互称为同素异形体难度: 中等查看答案及解析
-
下列既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应
B.Ba(OH)2•8H2O与NH4Cl的反应
C.灼热的炭与水蒸气的反应
D.甲烷(CH4)在O2中的燃烧反应难度: 中等查看答案及解析
-
下列大小比较正确的是( )
A.稳定性:HI>HBr>HCl>HF
B.元素非金属性:Si>P>S>Cl
C.沸点:正丁烷>异丁烷>丙烷
D.碱性:NaOH>KOH>Ca(OH)2>Ba(OH)2难度: 中等查看答案及解析
-
下列有关能量转换的说法正确的是( )
A.氢氧燃烧电池是将化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化是葡萄糖的总内能完全转变成能CO2和H2O的总内能
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.用硫氰化钾溶液检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓
B.钢铁生锈的负极电极反应:Fe-3e-=Fe3+
C.证明氯气氧化性大于硫可用:Cl2+S2-=2Cl-+S↓
D.用钠与硫酸铜溶液反应证明金属性钠更强:2Na+Cu2+=Cu+2Na+难度: 中等查看答案及解析
-
二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等中的致冷剂.
下列关于二氟甲烷的说法正确的( )
A.二氟甲烷是正四面体结构
B.二氟甲烷溶于水得F-离子
C.二氟甲烷中两个氢原子性质相同
D.二氟甲烷是极易与O3反应难度: 中等查看答案及解析
-
A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式可能表示为( )
A.B3A2
B.BA2
C.A3B2
D.AB2难度: 中等查看答案及解析
-
一定条件下,对于可逆反应N2(g)+3H2(g)⇌2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,则下列判断正确的是( )
A.C1:C2=1:3
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2、H2的转化率之比为1:3
D.C1的取值范围为0.04mol•L-1<C1<0.14mol•L-1难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.丙烷的球棍模型: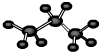
B.CO2的比例模型:
C.氢氧化钠的电子式:
D.次氯酸的结构式:H-Cl-O难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.含有共价键的化合物必是共价化合物
B.化学反应中一定有化学断裂,同时也有化学键形成
C.含有阴离子的化合物一定含有阳离子
D.金属元素和非金属元素形成的化合物不一定是离子化合物难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.标准状况时,22.4L二氯甲烷所含有的分子数为NA
B.将16gO2与32gSO2在一定的条件下充分反应生成的SO3分子数为NA
C.碱性锌锰电池中,当有1.3g的锌消耗,则转移的电子数为0.002NA
D.44g丙烷中含有的非极性共价键数为2NA难度: 中等查看答案及解析
-
由H79Br和H81Br组成的混合气体对N2的相对密度为2.9,则气体中79Br和81Br的原子个数比为( )
A.1:1
B.1:2
C.2:3
D.3:2难度: 中等查看答案及解析
-
在一个密闭容器中用等物质的量的A和B发生反应:A(g)+3B(g)
2C(g),该反应达到平衡时,平衡混和气中A的体积分数为( )
A.50%
B.60%
C.70%
D.无法计算难度: 中等查看答案及解析
-
有A、B、C、D四种金属,将A与B投入到等浓度的盐酸中,B比A反应激烈.将A与D用导线相连后浸入盐酸溶液中,发现A逐渐溶解,D上有气泡生成.将铜浸入D的盐溶液中,无明显变化,而把铜浸入C的盐溶液中,有金属C析出. A、B、C、D的活动性由强到弱的顺序是( )
A.A>B>D
B.B>A>D>C
C.C>D>A>B
D.B>A>C>D难度: 中等查看答案及解析
-
下列措施对增大化学反应速率无效果的是( )
A.KClO3分解制氧气时,加入少量MnO2催化剂且加热
B.做铝与稀盐酸反应的实验时,将铝片改为铝粉
C.铁与稀硫酸反应制取氢气时,改用质量分数为98%的浓硫酸
D.锌与稀硫酸反应时,加入少量氯化铜固体难度: 中等查看答案及解析