-
据最新报道,放射性同位素钬
Ho可有效地治疗肝癌。该同位素原子的质量数与核电荷数之差为
A.32 B.67 C.99 D.166
难度: 简单查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A.υ(H2)=0.3mol/(L·min) B.υ(N2)=0.2mol/(L·min)
C.υ(NH3)=0.25mol/(L·min) D.υ(H2)=0.4mol/(L·min)
难度: 中等查看答案及解析
-
下列物质中,只含有离子键,不含有共价键的是
A.HCl B.KOH C.CaCl2 D.CO2
难度: 中等查看答案及解析
-
在周期表中,金属元素和非金属元素的分界线附近能找到
A.制农药的元素 B.制催化剂的元素
C.制耐高温合金材料的元素 D.制半导体的元素
难度: 中等查看答案及解析
-
下列说法正确的是
A.物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
D.放热反应的发生无需任何条件
难度: 中等查看答案及解析
-
以下关于甲烷的说法中错误的是
A.甲烷分子具有正四面体结构
B.甲烷化学性质比较稳定,不被任何氧化剂氧化
C.甲烷分子中具有极性键
D.甲烷分子中四个C—H键是完全等价的键
难度: 中等查看答案及解析
-
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素原子最外层电子排布呈周期性变化
C.元素的相对原子质量依次递增
D.元素的最高正化合价呈周期性变化
难度: 中等查看答案及解析
-
有关叙述:能说明M比N的非金属性强的叙述是
①非金属单质M能从N的化合物中置换出非金属单质N。
②M原子比N原子容易得到电子。
③单质M跟H2反应比N跟H2反应容易得多。
④气态氢化物水溶液的酸性HmM>HnN。
⑤最高价氧化物对应水化物的酸性HmMOx>HnNOy。
⑥熔点M>N。
A.①②③⑤ B.②⑤
C.①②③④⑤ D.全部
难度: 中等查看答案及解析
-
下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰
A.③④ B.②③ C.①④⑤ D.②④
难度: 中等查看答案及解析
-
若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:①CH3Cl②CH2Cl2③CHCl3④CCl4,其中正确的是
A.只有① B.只有② C.①②③的混合物 D.①②③④的混合物
难度: 中等查看答案及解析
-
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属
B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
C.X2+的核外电子数目为18,则X在第四周期第ⅡA族
D.Mg(OH)2碱性比Ca(OH)2强
难度: 中等查看答案及解析
-
下列说法正确的是
A.由分子构成的物质一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子中的化学键一定都是极性键
难度: 中等查看答案及解析
-
下列说法中正确的是
A.相对分子质量相同的有机物是同分异构体
B.烷烃分子中,相邻的三个碳原子有可能在同一条直线上
C.每个碳原子的化合价都已“饱和”,碳原子之间只以单键相结合的链烃一定是烷烃
D.分子组成上相差一个或若干个CH2原子团的物质,互为同系物
难度: 中等查看答案及解析
-
在一定温度下,反应:2A(s)+2B(g)
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
A.单位时间内生成2a mol B,同时生成a molD
B.C的质量不再改变
C.容器内的压强不随时间而变化
D.混合气体的密度不再随时间而变化
难度: 中等查看答案及解析
-
下表是部分短周期元素的原子半径及主要化合价,根据表中的信息,判断下面叙述正确的是
元素代号
L
M
Q
R
T
原子半径(nm)
0.160
0.143
0.089
0.102
0.074
主要化合价
+2
+3
+2
+6、-2
-2
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.单质与同浓度的稀盐酸反应的速率为Q>L
D.R与T的氢化物熔沸点高低为H2R>H2T
难度: 中等查看答案及解析
-
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如下图。下列叙述中正确的是

A.反应的化学方程式为5Y⇋X
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
难度: 中等查看答案及解析
-
下列条件的改变,一定能加快化学反应速率的是
A.增大压强 B.升高温度
C.增大反应物的量 D.减小生成物的浓度
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>D>C B.单质的还原性:A>B>D>C
C.原子序数:d>c>b>a D.离子半径:C>D>B>A
难度: 中等查看答案及解析
-
将0.4mol丁烷完全燃烧后生成的气体全部缓慢通人1L 2mol/LNaOH溶液中,生Na2CO3和NaHCO3的物质的量之比为
A.3:2 B.2:3 C.2:1 D.1:3
难度: 中等查看答案及解析
-
据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2OH--2e-=ZnO+H2O
C.正极发生氧化反应
D.电解液肯定是强酸
难度: 中等查看答案及解析
-
依据氧化还原反应: 2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
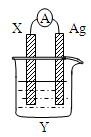
(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为_______ ___;X电极上发生的电极反应为_____________________;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。
(4)当有1.6g铜溶解时,银棒增重_________________。
难度: 中等查看答案及解析
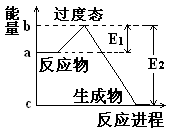 理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,
理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,