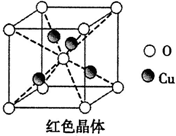
-
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.绿色化学的核心是利用化学原理治理环境污染
C.将煤气化或液化,获得清洁燃料
D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.核内有8个中子的碳原子:
B.甲烷分子的比例模型:

C.羟基的电子式:
D.氯离子的结构示意图:
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO42-
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3-
C.使甲基橙变红色的溶液中:Fe2+、K+、NO3-、SO42-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl-
难度: 中等查看答案及解析
-
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
下列装置进行相应的实验,能达到实验目的的是
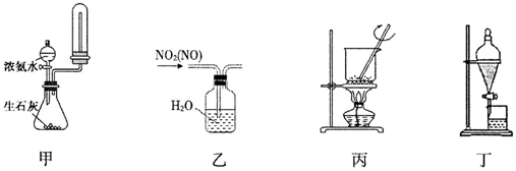
A.用装置甲制取并收集干燥纯净的NH3 B.用装置乙除去NO2中的少量NO
C.用装置丙将海带灼烧成灰 D.用装置丁分离乙酸乙酯和饱和碳酸钠溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA
B.标准状况下,22.4 L甲苯中含C-H数目为8 NA
C.常温下,9.2 g NO2和N2O4的混合气体中含有的氮原子数目为0.2 NA
D.1 mol氯气和足量NaOH溶液反应转移的电子数目为2NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O → C6H5OH+HCO3-
B.AlCl3溶液中加入少量氨水:Al3++3OH- = Al(OH)3↓
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH- = Fe(OH)2↓
D.用惰性电极电解氯化钠溶液:2Cl-+2H+ 通电 H2↑+Cl2↑
难度: 中等查看答案及解析
-
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
选项
物质转化关系
甲
乙
丙
丁
A

NaOH
NaHCO3
Na2CO3
CO2
B
AlCl3
NaAlO2
Al(OH)3
NaOH
C
Fe
Fe(NO3)3
Fe(NO3)2
HNO3
D
C
CO
CO2
O2
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>Z>X>Y
C.气态氢化物的沸点:Y>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
难度: 中等查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是 ( )

A.S(s,单斜) = S(s,正交) △H = + 0.33 kJ·mol-1
B.相同物质的量的正交硫比单斜硫所含有的能量高
C.正交硫比单斜硫稳定
D.①表示断裂1mol O2中的共价键所吸收的能量比形成l mol SO2中的共价键所放出的能量少297.16 kJ
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.反应Hg(1)+H2SO4(aq) = HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0
C.将纯水加热至较高温度,K变大、pH变小、呈酸性
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
难度: 中等查看答案及解析
-
普罗加比对癫痫、痉挛和运动失调均有良好的治疗效果,其结构如图所示,有关普罗加比的说法正确的是( )
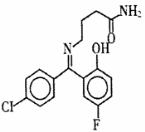
A.该分子在1H核磁共振谱中有12个峰
B.一定条件下,1 mol普罗加比最多能与2 mol H2发生加成反应
C.久置在空气中的普罗加比会因氧化而变质
D.普罗加比可以和NaOH溶液、Na2CO3溶液反应,也可以和盐酸反应
难度: 中等查看答案及解析
-
下列依据相关实验得出的结论正确的是
A.向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42-
B.向1mL l% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL 5%葡萄糖溶液,加热,未出现红色沉淀,证明葡萄糖中不含醛基
C.用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中含Na+
D.检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.pH =11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+)
C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) = 0.1 mol·L-1
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性: c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+)
难度: 中等查看答案及解析
-
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中不正确的是
甲
乙
丙
丁
密闭容器体积/L
2
2
2
2
起始物质的量
n(SO2)/mol
0.40
0.80
0.80
0.40
n(O2)/mol
0.24
0.24
0.48
0.24
SO2的平衡转化率%
80
1
2
3
A.甲中反应的平衡常数小于乙 B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:
1<
2 =
3 D.容器中SO3的物质的量浓度:丙=丁<甲
难度: 中等查看答案及解析
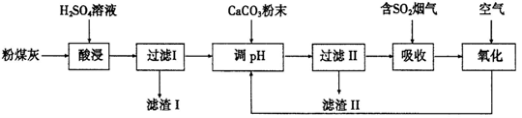
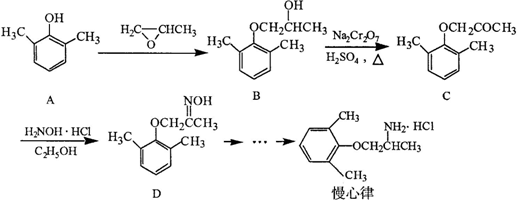
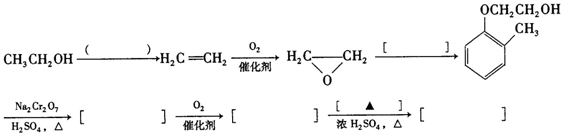
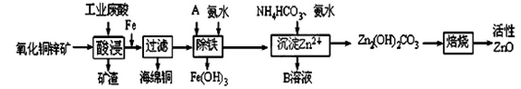
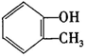 )和乙醇为原料制备
)和乙醇为原料制备 的合成路线流程图。
的合成路线流程图。