-
关于下列诗句或谚语,说法不正确的是( )
A.“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然
现象,与胶体知识有关
B.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
C.“滴水石穿、绳锯木断”不包含化学变化
D.“落汤螃蟹着红袍”肯定发生了化学变化
难度: 中等查看答案及解析
-
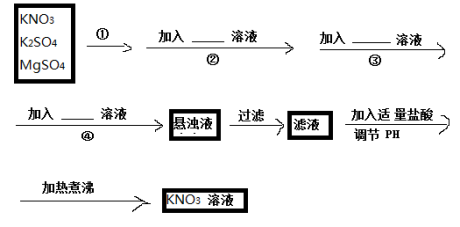
下列物质分类的正确组合是( )
混合物
化合物
单质
盐
A
NaOH溶液[_K]
盐酸
石墨
食盐
B
澄清石灰水
KNO3晶体
O3
纯碱(Na2CO3)
C
空气
石灰石
铁
消石灰
D
CuSO4·5H2O
CaCl2
水银
CaO
难度: 中等查看答案及解析
-
为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是( )
A.过滤 B.电泳
C.渗析 D.加入AgNO3溶液,过滤
难度: 简单查看答案及解析
-
下列化学实验操作或事故处理方法正确的是( )
A. 配制稀硫酸时,先在量筒中加入一定量的水,再边搅拌边慢慢加入浓硫酸
B. 浓硫酸沾到皮肤上时,先立即用大量水冲洗,再涂上3%~5%的NaOH溶液
C. 电失火时,不能用水灭火,可以用泡沫灭火器灭火
D. 无毒的药品也不要用手直接接触,更不要用嘴尝药品
难度: 中等查看答案及解析
-
下列说法中
,正确的是( )
A.含氧的化合物一定是氧化物 B.酸根中不一定含有氧元素
C.盐的组成中一定含有金属元素 D.酸中一定不含金属元素
难度: 中等查看答案及解析
-
能用H++OH-=H2O表示的是( )
A.Ba(OH)2溶液和稀H2SO4的反应 B.NaOH溶液和盐酸的反应
C.Cu(OH)2和稀H2SO4的反应 D.NaOH溶液和CO2的反应
难度: 中等查看答案及解析
-
使等体积的AlCl3、CaCl2、NaCl溶液中的Cl-完全转化为AgCl,所用0.1 mol/L AgNO3溶液的体积相同,这三种溶液的物质的量浓度之比为( )
A.1:2:3 B.1:1:1 C.2:3:6 D.6:3:2
难度: 极难查看答案及解析
-
下列实验中,所选装置不合理的是
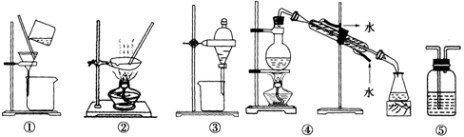
A.分离Na2CO3溶液和苯,选④ B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤ D.粗盐提纯,选①和②
难度: 中等查看答案及解析
-
关于氧化还原反应,下列说法正确的是( )
①氧化剂发生氧化反应
②氧化剂具有氧化性
③某元素在反应中由化合物转化为单质,该元素一定被氧化
④物质所含元素化合价变化是判断氧化还原反应的依据
⑤失电子越多的还原剂,其还原性越强
A.①②④ B.②③④ C.②④ D.②④⑤
难度: 困难查看答案及解析
-
除去下列物质中少量杂质(括号内为杂质),试剂或方法错误的是( )
A.NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶
B.CO(水蒸气)通过浓硫酸的洗气瓶
C.CaO固体(CaCO3)高温煅烧
D.KCl固体(MnO2)溶解、过滤、蒸发
难度: 中等查看答案及解析
-
氧化还原反应实际上包含氧化和还原两个过程:(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为SO2+2H2O-2e-=SO42-+4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为Cl2+2e-=2Cl-。已知在(1)和(2)中的反应均会生成产物X,则X的化学式为( )
A.NaClO B.NaClO4 C.HClO D.ClO2
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氧化铜与稀硝酸反应:CuO+2H+=Cu2++H2O
B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓
D.澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A.1 mol O2作为氧化剂失去的电子数为4NA
B.标准状况下,22.4L CCl4所含的分子数大于NA
C.1mol/L NaCl溶液所含的Cl﹣物质的量NA
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
难度: 困难查看答案及解析
-
正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:

已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点
34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点118℃。则操作1~4分别是( )
A.萃取、过滤、蒸馏、蒸馏 B.过滤、分液、蒸馏、萃取
C.过滤、蒸馏、过滤、蒸馏 D.过滤、分液、过滤、蒸馏
难度: 极难查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有―银针验毒的记载,“银针验毒”的原理是
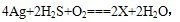 下列说法正确的是( )
下列说法正确的是( )A.X的化学式为AgS B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂 D.每生成1molX,反应转移2mol e-
难度: 中等查看答案及解析
-
下列关于胶体的叙述不正确的是( )
A.胶体区别其他分散系的本质特征是分散质的微粒直径在10﹣9~10﹣7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固
体颗粒沉降,达到净水目的
难度: 中等查看答案及解析
-
下列溶液中,能大量共存的离子组是 ( ) 、
A.遇酚酞试剂变红的溶液:K+、Cu2+、NO3-、SO42-
B.遇紫色石蕊试剂变红的溶液:K+、Na+、Cl-、CO32-
C.常温pH<7的溶液:Ba2+、NH4+、NO3-、Cl-
D.无色透明溶液中:K+、Na+、MnO4-、SO42-
难度: 中等查看答案及解析
-
下列状态的物质,既能导电又属于电解质的是( )
A.MgCl2晶体B.NaCl溶液 C.液态氯化氢 D.熔融的KOH
难度: 简单查看答案及解析
-
有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O下列说法正确的是( )
A.反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C.可以推理得到Cl2+FeBr2=FeCl3+Br2
D.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
难度: 极难查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
实验目的
实验操作
A
称取2.0gNaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
制备Fe(OH)3胶体
向沸水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色
C
检验溶液中是否含有SO42-
取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42-
D
萃取碘水中的碘
将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出
难度: 困难查看答案及解析
-
已知在酸性溶液中,下列物质氧化Fe2+时,自身发生如下变化:HNO3→NO;Br2→2Br﹣;ClO﹣→Cl﹣;MnO4﹣→Mn2+如果分别用等物质的量的这些物质氧化足量的FeCl2溶液,得到Fe3+最多的是
A.MnO4﹣ B.Br2 C.ClO﹣ D.HNO3
难度: 中等查看答案及解析
-
下图为某市售盐酸试剂瓶标签上的部分数据。下列说法正确的是:

A. 足量的该盐酸与1molFe反应生成22.4L H2
B. 该盐酸的物质的量浓度为11.8mol/L
C. 该盐酸与等体积的水混合后所得溶液的物质的量浓度为5.9mol/L
D. 配制80mL 5.9mol/L 的盐酸需用量筒量取40mL该盐酸
难度: 中等查看答案及解析
-
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.每生成1mol Fe3O4,则转移电子数为2mol
C.参加反应的氧化剂与还原剂的物质的量之比为1:1
D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
难度: 困难查看答案及解析
-
某溶液中,只可能含有下列离子中的几种:
阳离子
K+、Mg2、Fe3+、Al3+
阴离子
Cl-、SO42-、CO32-
现每次取100.00mL溶液进行实验:①第一份加入硝酸银溶液有沉淀产生;②第二份加入足量氯化钡溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。下列说法错误的是( )
A.c(CO32-)=0.2 mol/L B.c(K+)一定为0.6mol/L
C.氯离子可能存在 D.一定有SO42-和CO32-
难度: 极难查看答案及解析
-
向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液,产生沉淀的物质的量与加入Ba(OH)2溶液体积间的关系图正确的是( )
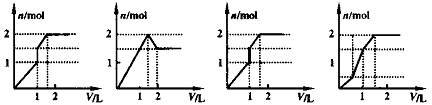
A B C D
难度: 困难查看答案及解析