-
下列实验基本操作(或实验注意事项)中,主要考虑实验安全的是( )
A. 实验剩余的药品不能放回原试剂瓶 B. 可燃性气体的验纯
C. 气体实验装置在实验前进行气密性检查 D. 滴管不能交叉使用
难度: 简单查看答案及解析
-
下列实验操作正确的是( )

难度: 简单查看答案及解析
-
下列事故处理方法正确的是( )
A. Na着火时,立即用水灭火
B. 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火
C. 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D. 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
难度: 中等查看答案及解析
-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原因是( )
A.胶体的电泳 B.血液的氧化还原反应
C.血液中发生复分解反应 D.胶体的聚沉
难度: 中等查看答案及解析
-
已知甘油(C3H8O3)通常是无色液体,易溶于水,密度比水大,沸点约为290.9℃。要从甘油、水的混合物中分别得到甘油与水,最佳方法是( )
A.分液 B.过滤
C.蒸馏 D.蒸发
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的有( )
A.28克亚铁
离子得到NA个电子被氧化成单质铁
B.1mol/L的BaCl2溶液中含约1.204×1024个Cl-
C.在0℃、1.01×105Pa的条件下,2.24L 盐酸中含有的原子数为0
.2NA
D.1mol Na2O2中离子数为3NA
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.有单质生成的反应一定存在元素化合价的变化
B.化学反应中某元素化合价升高必定存在另一元素化合价降低
C.氧化还原反应的实质是有离子定向移动
D.氧化还原反应不一定都是置换反应
难度: 简单查看答案及解析
-
下列物质中,属于电解质但
不能导电的是( )
A.四氯化碳 B.熔融的氯化铝 C.液态氯化钠 D.石墨
难度: 简单查看答案及解析
-
下列有关物质制备的反应中,其原理不属于氧化还原反应的是( )
A.制金属钛 B.湿法炼铜 C.实验室制O2 D.侯氏制碱
难度: 简单查看答案及解析
-
室温下,等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是( )
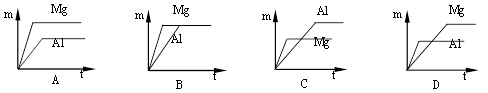
难度: 中等查看答案及解析
-
某学生只有下列仪器和用具:烧杯、试管、硬质玻璃管、圆底烧瓶、量筒、铁架台(带铁夹)、酒精灯、集气瓶、玻璃片、水槽、导气管、橡皮塞、橡皮管、100mL容量瓶、玻璃棒、药匙、火柴。从缺少仪器或用品的角度看,该学生能进行的实验操作是( )
A. 制蒸馏水
B. 用氯化钠晶体配制100mL0.1mol·L—1的氯化钠溶液
C. 粗盐提纯
D. 氢气还原氧化铜
难度: 困难查看答案及解析
-
下列分子或离子在无色透明的溶液中能大量共存的是( )
A.Na+、H+、CO32-、H2O2 B.Ca2+、NO3-、OH-、HCO3-
C.Na+、OH-、Cl-、NH3·H2O D.Na+、Fe3+、S
O42-、Cl-
难度: 中等查看答案及解析
-
下列各组离子,可以形成透明溶液的是( )
A.Cu2+ 、NH4+ 、H+、SO42- B.Mg2+、Na+、Cl-、OH-
C.Na+、 Ba2+、OH- 、CO32- D.Ag+、Al3+、SO42-、Cl-
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用NaHCO3中和过多的胃酸:CO32-+2H+=CO2↑+H2O
B.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.将氢氧化铁放入盐酸中:Fe(OH)3 + 3H+ = Fe3+ +
3H2O
D.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
难度: 中等查看答案及解析
-
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号
物质
杂质
除杂试剂或操作方法
①
NaCl溶液
Na2CO3
加入盐酸,蒸发
②
FeSO4溶液
CuSO4
加入过量铁粉并过滤
③
H2
CO2
依次通过盛有NaOH溶液和浓硫酸的洗
气瓶
④
NaNO3
CaCO3
加稀盐酸溶解、过滤、蒸发、结晶
A.①②③ B.①②③④ C.②③④ D.①③④
难度: 中等查看答案及解析
-
两种金属混合物粉末12g,与足量的盐酸反应生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
A.Mg、Fe B.Zn、Ag C.Mg、Al D.Al、Zn
难度: 困难查看答案及解析

