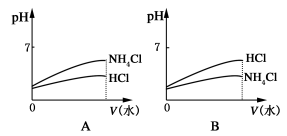
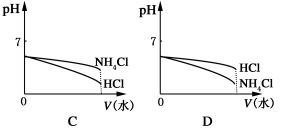
-
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合成新的物质。根据上述观点,下列说法不正确的是( )
A.NaClO的水解产物是HClO和NaOH
B.CuCl2的水解产物是Cu(OH)2和HCl
C.PCl3的水解产物是PH3和HClO
D.CaO2的水解产物是Ca(OH)2和H2O2
难度: 中等查看答案及解析
-
下列根据反应原理设计的应用,不正确的是( )
A.CO
+H2O
HCO
+OH- 与Al2(SO4)3溶液混合作灭火剂
B.Al3++3H2O
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D.SnCl2+H2O
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸
难度: 中等查看答案及解析
-
下列各组离子能大量共存,且溶液为无色透明的是( )
A.Al3+、AlO2-、NO3-、Cl-
B.CrO42-、H+、K+、NO3-
C.Ba2+、Na+、HCO3-、OH-
D.K+、SO42-、S2-、Na+
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、CH3COOH、C2H5OH、HCl
难度: 中等查看答案及解析
-
下列溶液在空气中加热、蒸干、灼烧后,所得固体为原溶液中的溶质的是( )
A.(NH4)2SO3 B.KMnO4
C.AlCl3 D.Na2CO3
难度: 中等查看答案及解析
-
下列与平衡移动无关的是( )
A.向0.1 mol/L的CH3COOH中加水稀释,溶液pH增大
B.向氯水中投入AgNO3,最终溶液酸性增强
C.夏天,打开冰镇啤酒的盖子后,有大量的气泡冒出
D.在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA
B.pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA
C.在1L 0.1 mol·L-1 CuSO4溶液中,阴离子总数大于0.1 NA
D.某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA
难度: 困难查看答案及解析
-
为了区别五瓶无色溶液:HC1、A1C13、Ba(NO3)2、NaC1、Na2CO3,四位学生都没有用酒精灯,三位学生另用了试剂(甲另用了酚酞试剂、乙另用了NaOH溶液、丙另用了紫色石蕊试液),丁没有另用任何试剂,其中操作步骤一定最少的是 ( )
A.甲和丙 B.乙 C.乙和丙 D.丁
难度: 中等查看答案及解析
-
t℃时,水的离子积为Kw,该温度下混合可溶性一元酸HA和一元碱BOH。以下说法可确认混合后溶液一定呈中性的是( )
A.pH=7 B.c(A—) + c(OH—) = c(H+) + c(B+)
C.c(A—) = c(B+) D.c(OH—) =
难度: 中等查看答案及解析
-
在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)( )
A.11.52 B.11.70
C.11.82 D.12.00
难度: 困难查看答案及解析
-
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是( )
A.b>a=d>c B.a=b>c>d
C.a=b>d>c D.c>a=d>b
难度: 困难查看答案及解析
-
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,Y能分别与X、Z形成原子个数比为1: 3的化合物,常温下YX3是一种刺激性气味的气体。下列说法正确的是( )
A.原子半径:Z<Y<W,而离子半径:W<Y<Z
B.W的氯化物水溶液中滴加过量NaZ饱和溶液,可生成W的配合物用于冶金工业
C.由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度
D.已知YX3沸点远高于YZ3,则Y—X键的键能高于Y—Z键
难度: 困难查看答案及解析
-
下列实验过程中曲线变化正确的是( )
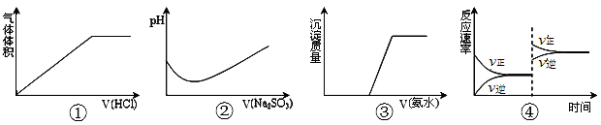
A.①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示AgNO3溶液中滴入氨水
D.④表示一定条件下2SO2+O2
2SO3 △H<0达平衡后,升高温度
难度: 中等查看答案及解析
-
氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是( )
A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B.水电离的热化学方程式为:H2O(1)
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C.当c > 0.1时,一定不存在:c(Na+) = c(F—)
D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
难度: 困难查看答案及解析