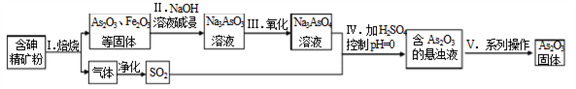
-
下列说法错误的是
A. Na2O2可用作供氧剂
B. Al2O3可用作耐火材料
C. 地沟油经处理后可用作燃料油
D. 胶体和溶液的本质区别是胶体具有丁达尔现象
难度: 中等查看答案及解析
-
下列有关丙烯酸(CH2=CHCOOH)的说法正确的是
A. 丙烯酸使溴水褪色属于氧化反应
B. 丙烯酸能发生加成反应但不能发生取代反应
C. 丙烯酸分子中所有碳原子不可能处于同一平面
D. 反应 CH2=CHCOOH+H2
CH3CH2COOH的原子利用率为100%
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示。一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的—半。下列说法正确的是
W
X
Z
A. 非金属性:W < Z
B. 简单离子的半径:X2- < Y2+
C. 沸点:H2X < H2Z
D. WX2的电子式为:
难度: 中等查看答案及解析
-
一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g)
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
时间(min)
0
t1
t2
t3
NH3物质的量(mol)
0
0.2
0.3
0.3
A. 0〜t1min,v(NH3)=
mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C. N2(g)+3H2(g)
2NH3(g)的活化能小于2NH3(g)
N2(g)+3H2(g)的活化能
D. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
难度: 中等查看答案及解析
-
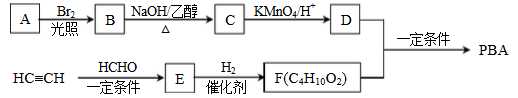
某芳香族化合物的分子式为C7H6Cl2,该有机物的可能结构有(不考虑立体异构)
A. 9种 B. 10种 C. 11种 D. 12种
难度: 中等查看答案及解析
-
用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是
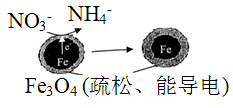
A. 能量转化形式主要为化学能转化为电能
B. 电极材料分别为Fe和Fe3O4
C. 负极反应为:NO3-+8e-+l0H+==NH4++3H2O
D. 该原理的总反应可表示为:NO3-+3Fe+2H++H2O= NH4+ +Fe3O4
难度: 中等查看答案及解析
-
常温下,某溶液X由Fe3+、SO42-、Cu2+、Na+、CO32-、Al3+中的几种离子组成。取少量待测液滴加KSCN溶液,溶液变红;另取少量待测滴加NaOH溶液至pH=4后过滤,向滤液中继续滴加NaOH溶液至过量时又得到沉淀W和溶液Y。可能用到的数据如下表所示,下列说法正确的是
沉淀物
Fe(OH)3
Cu(OH)2
Al(OH)3
开始沉淀的pH
1.9
4.7
3.4
沉淀完全的pH
3.2
6.7
4.7
A. 该温度下Ksp[Fe(OH)3]=1×10-14.6
B. W主要含有 Cu(OH)2和Al(OH)3
C. 溶液X中一定含有Cu2+、Fe3+和SO42-
D. 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+
难度: 困难查看答案及解析