-
下列各组物质中,分子数相同的是( )
A. 2 L SO2和2 L CO2 B. 9 g水和标准状况下11.2 L CO2
C. 标准状况下1 mol氧气和22.4 L水 D. 0.1 mol氢气和2.24 L氯化氢气体
难度: 中等查看答案及解析
-
下列有关阿佛加德罗常数(NA)的说法错误的是
A.32克O2所含的原子数目为NA
B.0.5 mol H2O含有的原子数目为1.5NA
C.1 mol H2O含有的H2O分子数目为NA
D.0.5 NA个氯气分子的物质的量是0.5 mol
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 等物质的量的N2和CO所含分子数均为NA
B. 常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA
C. 欲配置1.00L ,1.00mol·L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D. 标准状况下,22.4L空气含有NA个单质分子
难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A. ④②⑤ B. ④①②⑤③ C. ②⑤④①③ D. ①④②⑤③
难度: 困难查看答案及解析
-
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据你掌握的知识判断,下列事故处理正确的是( )。
A. 酒精在实验台上着火,迅速用水熄灭
B. 实验室里电线失火,首先要断开电源
C. 浓硫酸沾到皮肤上,先用大量水冲洗,再用醋酸清洗
D. 腐蚀性药品溅到眼睛里,迅速送往医院治疗
难度: 中等查看答案及解析
-
在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的 ( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
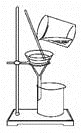
下列过滤操作正确的是( )。
A. 过滤操作中,漏斗下端与烧杯内壁不相互接触
B. 若发现滤纸漏液,可继续过滤
C. 为加快过滤速度,可用玻璃棒搅拌漏斗中的液体
D. 玻璃棒下端应紧靠三层滤纸处
难度: 困难查看答案及解析
-
蒸发时,下列操作正确的是( )。
A. 使蒸发皿盛满滤液,用小火加热 B. 等到蒸发皿中出现较多固体时停止加热
C. 待溶液蒸干后,再停止加热 D. 将蒸发皿放在石棉网上,用酒精灯加热
难度: 中等查看答案及解析
-
下列各组混合物,不能用分液漏斗分离的是( )
A. 汽油和水 B. 苯和水 C. 酒精和水 D. 水和四氯化碳
难度: 中等查看答案及解析
-
向装有碘水的试管中加CCl4振荡,静置后,你观察到的现象是
A. 上层几乎无色,下层紫红色 B. 上层紫红色,下层几乎无色
C. 上层几乎无色,下层橙色 D. 不分层,紫红色
难度: 中等查看答案及解析
-
下列仪器使用时允许用酒精灯直接加热的是( )。
A. 量筒 B. 蒸馏烧瓶 C. 试管 D. 烧杯
难度: 中等查看答案及解析
-
完成下列实验所需选择的装置或仪器都正确的是
A
B
C
D
实验
分离植物油和氯化钠溶液
除去氯化钠晶
体中混有的氯化铵
晶体分离CCl4
中的Br2除去CO2气体
中的HCl气体装置
或仪器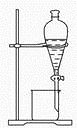
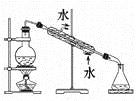
难度: 中等查看答案及解析
-
对下列实验过程的评价,正确的是( )
A. 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO
C. 用萃取的方法分离汽油和煤油
D. 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
难度: 困难查看答案及解析
-
下列关于物质的量的说法中正确的是 ( )
A. 摩尔既是物质的量的单位,又是粒子数量的单位 B. 物质的量实质上就是物质的质量
C. 物质的量是一种物理量的单位 D. 物质的量是国际单位制中的七个基本物理量之一
难度: 中等查看答案及解析
-
瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积为 ( )
A. 1 :4 B. 1 :2 C. 1 :1 D. 2 :1
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A. H2SO4 的摩尔质量是 98 g
B. 1 mol H2O 的质量是 18 g/mol
C. Cl-的摩尔质量是 35.5 g/mol
D. 1 mol N2 的体积是 22.4 L
难度: 简单查看答案及解析
-
下列各组物质中,所含分子数相同的是
A.10g H2和10g O2 B.5.6L N2(标准状况)和22g CO2
C.9g H2O和0.5mol Br2 D.224ml H2(标准状况)和0.lmol N2
难度: 中等查看答案及解析
-
1 mol下列气体中所含原子数最多的是 ( )
A. H2 B. CO2 C. CH4 D. O2
难度: 中等查看答案及解析
-
下列关于阿伏加德罗常数的说法中正确的是 ( )
A. 6.02×1023叫做阿伏加德罗常数
B. 12 g碳12含有的碳原子数就是阿伏加德罗常数
C. 含有阿伏加德罗常数个微粒的物质是1摩尔
D. 1摩尔氯含有6.02×1023个氯分子
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 1 mol氧 B. SO42-的摩尔质量是96 g
C. 3 mol小麦 D. 标准状况下,1 mol O2
难度: 中等查看答案及解析
-
0.25 mol A的质量是16 g,A的相对分子质量(或相对原子质量)是( )
A. 32 g·mol―1 B. 64 g·mol―1 C. 32 D. 64
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列有关说法正确的是( )
A.在常温常压下,11.2 L O2含有的分子数为0.5NA
B.在常温常压下,1 mol氦气含有的原子数为2NA
C.71 g Cl2所含原子数为2NA
D.标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L
难度: 中等查看答案及解析
-
0.5L 1mol/L FeCl3溶液中的Cl-的物质的量浓度为
A.3 mol/L B.1.5 mol/L C.1 mol/L D.0.5 mol/L
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 L HCl和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
A. ①②③④ B. ②③ C. ⑤ D. ④
难度: 困难查看答案及解析
-
将BaCl2溶液加入某无色溶液后,生成白色沉淀,再加入稀HNO3 ,则沉淀不溶解。下列说法正确的是( )
A. 一定存在Ag+ B. 一定存在CO32-
C. 一定存在SO42- D. 以上说法都不对
难度: 中等查看答案及解析