-
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
注意事项
理由
①
______________
____________
②
________________
____________
难度: 困难查看答案及解析
-
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下:
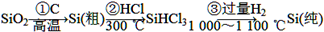
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
物质
SiHCl3
SiCl4
HCl
沸点
33.0 ℃
57.6 ℃
-84.7 ℃
在步骤②中提纯SiHCl3所进行的主要操作的名称是________。
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。
①下列物质中不属于合金的是( )。
A.钢铁 B.青铜 C.硬铝 D.水银
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈。试写出保护铜制品的方法:___________________________________________________。
(3)纳米材料,胶体粒子的直径大约是________,与纳米材料的尺寸相当。实验室制取Fe(OH)3胶体溶液的方法是_________________________________,
用________方法消除胶体中的浑浊,根据________现象证明胶体已经制成。实验中必须要用蒸馏水,而不能用自来水,其原因是____________________。
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66 g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。①该磁性粉末中氧元素的质量分数为________;②该材料的化学式为________。
难度: 困难查看答案及解析
-
碳酸锂广泛应用于陶瓷和医药等领域,以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
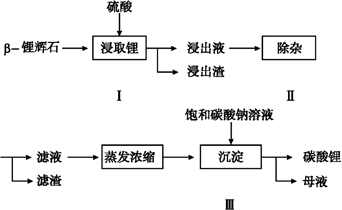
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β—锂辉石要粉碎成细颗粒的目的是 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-;另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为 ________。
(5)从母液中可回收的主要物质是 ________。
难度: 极难查看答案及解析
-
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是_________________________________________________________________。
(3)写出沉淀物中所有物质的化学式___________________________________。
(4)滤液Ⅰ的成分是水和______________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为__________mol(用含有m、n的代数式表示)。
难度: 困难查看答案及解析
-
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(3)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率
为何值?
难度: 中等查看答案及解析
-
信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
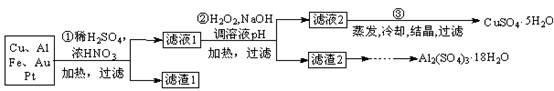
回答下列问题:
⑴第①步Cu与酸反应的离子方程式为;得到滤渣1的主要成分为________。
⑵第②步加入H2O2的作用是________,使用H2O2的优点是________;调节pH的目的是使________生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
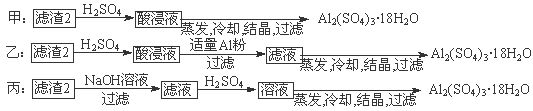
上述三种方案中,________方案不可行,原因是________;
从原子利用率角度考虑,________方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω=________;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
难度: 极难查看答案及解析
-
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
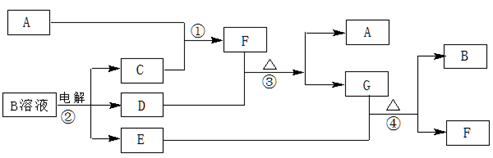
(1)写出化学式A________,D________,F________,G属于________晶体;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式、。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 ________。
难度: 极难查看答案及解析
-
(1)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,则该复合材料的基体和增强体材料分别可能是( )
A.金属;碳纤维
B.陶瓷;SiO2
C.合成树脂;SiO2、Al2O3、Na2O
D.合成树脂;碳纤维
(2)石黑炸弹也叫断电炸弹、轻炸弹,专用于破坏敌方的电力设施。这种炸弹爆炸后会喷散出大量经化学方法制成的石墨丝(碳纤维),其直径仅有几千分之一英寸。这种石墨丝非常轻,在目标上空可飘浮较长一段时间,形成较大范围的“碳纤维云”,它们粘上电力设施时,即会破坏电力系统。简述石墨炸弹能够破坏电力系统的原因:
难度: 中等查看答案及解析
-
光纤预制棒是光缆生产的最“源头”项目,目前国内光缆生产厂家约200家,大部分靠买进口光纤预制棒来生产光缆。
(1)光纤预制棒跟光导纤维的成分相同,那么光纤预制棒的化学成分是________。
(2)如果把光缆裸露在碱性土壤中,结果会短路,用离子方程式说明原因________。
(3)下列说法正确的是________。
A.石英与普通玻璃都是硅酸盐制品
B.二氧化硅是良好的半导体材料
C.工艺师用盐酸刻蚀石英制作艺术品
D.石英与二氧化碳中的化学键相同
(4)石英可以制备各种各样的陶瓷制品,如坩埚、蒸发皿、氮化硅高温结构陶瓷等。写出氮化硅的化学式________,工业上用石英、焦炭、氮气在高温条件下制备氮化硅,写出反应的化学方程式________。
难度: 中等查看答案及解析
-
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
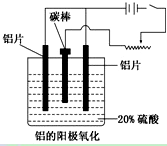
2Al2O3
4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
难度: 困难查看答案及解析
-
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的。图中M(C3H4O)和A均能发生银镜反应。N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种。
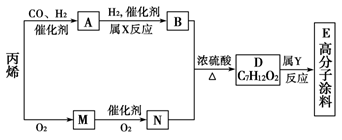
试写出:
(1)下列物质的结构简式:
A________;M________;E________。
(2)物质A的同类别的同分异构体的结构简式为______________。
(3)反应类型:X______________;Y__________________。
(4)写出D→E的化学方程式:____________________。
难度: 极难查看答案及解析





