-
非金属氧化物采用不同的分类方法可分为不同的类别,从某种意义将N2O5、SO3、CO2、Cl2O7等归为一类。则下列氧化物与它们属于同一类的是( )
A.CO B.NO2 C.SO2 D. NO
难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数,下列叙述正确的( )
A.标准状况下,NA个SO3分子所占的体积约为22.4 L
B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA
C.铁粉与一定量的浓硫酸反应,若产生11.2 L SO2和1 g H2,铁粉失去的电子数为2NA
D.50 mL 12 mol•L-1 浓盐酸与足量二氧化锰反应,转移电子数为0.3 NA
难度: 中等查看答案及解析
-
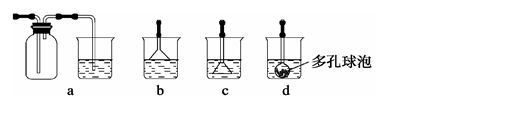
实验室常采用点滴板来完成部分实验,既可节约药品,又便于观察实验现象。图中所示的实验现象描述正确的是( )

①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中溶液呈黄色
A.①④B.②③C.①⑤D.②⑤
难度: 中等查看答案及解析
-
由一种阳离子与两种酸根离子组成的盐称为混盐。如CaOCl2是由Ca2+、Cl-、ClO-组成的混盐,在酸性条件下可以产生Cl2。下列有关判断不正确的是( )
A.CaOCl2属于混合物
B.CaOCl2的水溶液呈碱性
C.CaOCl2具有较强的氧化性
D.CaOCl2与硫酸反应转移l mol电子时生成71 gCl2
难度: 中等查看答案及解析
-
下列图像表示Al3+与AlO2-物质的量变化的曲线,实线表示Al3+,虚线表示AlO2-,其中正确的是( )
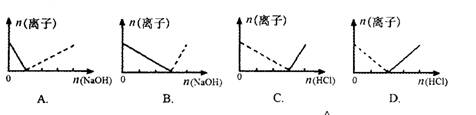
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.澄清石灰水中滴加过量的小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
C.H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
D.尼泊金酸(
)与碳酸氢钠溶液反应:

难度: 困难查看答案及解析
-
与一定浓度的
反应,生成
,当
的物质的量之比为
时,实际参加反应的
与
的物质的量之比为( )。
A.1:6 B.2:15 C.2:3 D.16:25
难度: 中等查看答案及解析
-
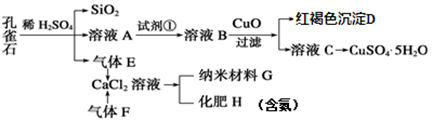
已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
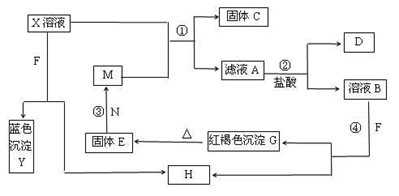
请回答下列问题:
(1)X的化学式为________。
(2)在反应①②③④中属于置换反应的是________(填序号)。
(3)反应③的化学方程式为_________________________________。
(4)X溶液与F反应的总化学方程式为________。
(5)检验滤液A中金属离子的方法是 ________。
(6)若向100 mL盐X的溶液中加入10 g过量金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体。则滤液A中溶质的物质的量浓度为_________。(假设溶液体积不变)
难度: 极难查看答案及解析