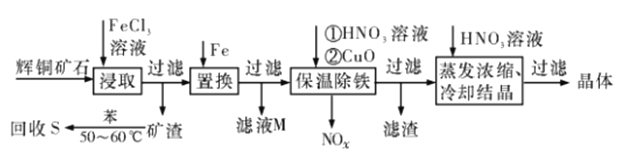
-
化学与生产、生活、技术密切关。下列说法错误的是
A. 含等物质的量的K2SO4和Al2(SO4)3的混合溶液蒸发浓缩,可以析出明矾晶体
B. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
C. 可在元素周期表过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
D. 涤纶、醇酸树脂、环氧树脂、酚醛树脂等高分子化合物都是缩聚反应制得的
难度: 中等查看答案及解析
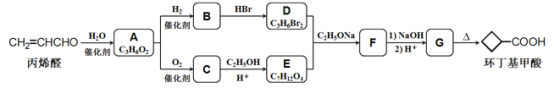
-
下列实验操作正确的是
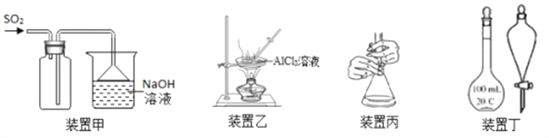
A. 用装置甲收集SO2
B. 用装置乙制备AlCl3晶体
C. 用装置丙进行中和滴定时,滴定前锥形瓶先用待装液润洗
D. 装置丁中使用分液漏斗和容量瓶时,先要检查仪器是否漏液
难度: 中等查看答案及解析
-
对某溶液中部分离子的定性检测流程如下。相关分析正确的是

A. 步骤①所加试剂可以是浓KOH溶液
B. 可以用湿润的蓝色石蕊试纸检验生成的无色气体
C. 步骤②反应A13++3HCO3- =AI(OH)3↓+ 3CO2↑
D. Fe2+遇铁氰化钾溶液显蓝色
难度: 中等查看答案及解析
-
甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是
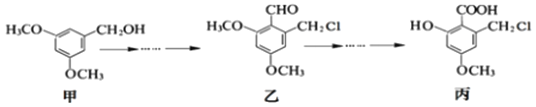
A. 甲、乙、丙三种有机化合物都能发生银镜反应
B. 乙分子中所有碳原子可能位于同一个平面
C. 甲分子苯环上的一氯代物有两种
D. 乙、丙均可与NaOH溶液发生反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C. 反应A(g)
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
难度: 中等查看答案及解析
-
最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
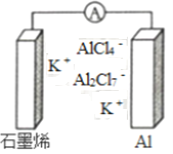
A. 放电时,Cn (石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e -=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
难度: 中等查看答案及解析
-
高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是

A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中

B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
难度: 中等查看答案及解析