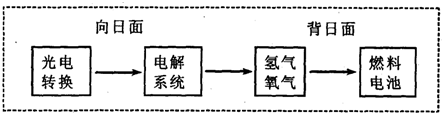
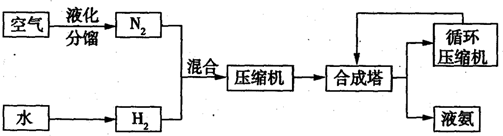
-
根据下表信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价( )
元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.112 0.104 0.066 主要化合价 +2 +3 +2 +6、-2 -2
A.氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L>Q
C.M与T形成的化合物具有两性
D.L2+ 与R2-的核外电子数相等难度: 中等查看答案及解析
-
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1:8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1molNO3-发生氧化反应,转移8mole-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+难度: 中等查看答案及解析
-
下列涉及有机物的说法正确的是( )
A.乙烯、氯乙烯、聚乙烯都是不饱和烃,均可用于有机高分子材料
B.丙烷是一种清洁燃料,可用作燃料电池的燃料
C.溴在酒精中溶解度较大,因此可以用酒精萃取溴水中的溴
D.淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体难度: 中等查看答案及解析
-
某无色混合盐溶液中,除水电离产生的离子外可能含有①Na+ ②Ba2+ ③Cl- ④Br- ⑤SO32- ⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )步骤 操作 现象 (1) 用pH试纸检验 溶液的pH大于7 (2) 向溶液中滴加氯水,再加入CCl4振荡,静置 CCl4层呈橙色 (3) 分液,向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 有白色沉淀产生 (4) 过滤,向滤液中加入AgNO3溶液和稀HNO3 有白色沉淀产生
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.只能确定④存在,②不存在难度: 中等查看答案及解析
-
化学反应中通常伴随着能量变化,下列说法中错误的是( )
A.TNT(炸药)爆炸时将部分化学能转化为动能
B.电解熔融Al2O3时将部分化学能转化为电能
C.镁条燃烧时将部分化学能转化为光能
D.煤燃烧时将部分化学能转化为热能难度: 中等查看答案及解析
-
造成环境污染的主要原因是由于人类生产活动中过度排放有关物质.下列环境问题不是由所对应的物质引起的是( )
A.温室效应--二氧化碳
B.酸雨--二氧化硫
C.光化学烟雾--二氧化氮
D.臭氧层破坏--氧化碳难度: 中等查看答案及解析
-
难溶于水的非金属氧化物是( )
A.MnO2
B.CO2
C.NO2
D.SiO2难度: 中等查看答案及解析
-
下列有关化学反应过程或实验现象的叙述中,正确的是( )
A.氨气的水溶液可以导电,说明氨气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C.氯气可以使湿润的有色布条褪色,说明氯气具有漂白作用
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去难度: 中等查看答案及解析
-
将足量的气体分别通入相应的溶液,下列实验一定可以得到沉淀的是( )
A.将SO2通入BaCl2溶液
B.将HCl通入NaAlO2溶液
C.将Cl2通入AgNO3溶液
D.将CO2通入Ca(OH)2溶液难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.氢氧化钡溶液与硫酸溶液混合:Ba2++SO42-═BaSO4↓
B.铁和稀硝酸反应:Fe+2H+═Fe2++H2↑
C.将铜片放入氯化铁溶液中:Fe3++Cu═Fe2++Cu2+
D.氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+难度: 中等查看答案及解析
-
下列实验所用试剂或方法正确的是( )
A.除去CO2中的HCl:饱和NaHCO3溶液
B.用广泛pH试纸测得某溶液的pH为3.3
C.提纯蛋白质:加入Pb(NO3)2溶液发生盐析
D.除去NO2中的NO:通入水中难度: 中等查看答案及解析
-
下列各组物质的稀盐酸混合,再加入足量稀硫酸,静置后,溶液颜色没有明显改变的是( )
A.酚酞溶液、Na2CO3、KNO3
B.Ba(NO3)2、NaNO3、CuCl2
C.FeCl2、KSCN、NaNO3
D.品红溶液、Na2SO3、KCl难度: 中等查看答案及解析
-
设阿伏伽德罗常数的数值为NA,下列说法正确的是( )
A.5.6g铁与足量的Cl2反应失去电子数为0.2NA个
B.1.5molNO2与足量H2O反应,转移的电子数为2NA
C.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
D.标况下22.4LO2和O3组成的混合物中总原子数为2NA个难度: 中等查看答案及解析
-
根据化学知识,下列说法正确的是( )
A.仅由非金属元素组成的化合物一定是共价化合物
B.普通陶瓷、玻璃、水泥是使用量最大的无机材料,其生产都采用含硅元素的原料
C.同一温度下,向饱和AgCl溶液中加入盐酸,AgCl的KSP变大
D.某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶了较多的CO2难度: 中等查看答案及解析
-
如图,MOH和ROH两种一元碱的稀溶液,分别加水稀释时pH变化可近似看作下图,下列说法错误的是( )

A.ROH是一种强碱
B.在x点,c(M+)=c(R+)
C.在x点,ROH完全电离
D.稀释前,c(ROH)=10c(MOH)难度: 中等查看答案及解析