-
短周期元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A. 原子半径: r(X) < r(Y) < r(Z) < r(W) B. W的最高价氧化物的水化物是一种弱碱
C. Y的单质的氧化性比Z的强 D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
下列化学技术与其试图解决的问题不对应的是( )
A. 某沿海城市技术开发公司研制的海水淡化膜——资源问题
B. 用石灰法进行工业废气脱硫——污染问题
C. 研制用纯净的二氧化硅做光导纤维——能源问题
D. 中科院研制的新型钛合金用于航空航天——材料问题
难度: 简单查看答案及解析
-
下列有关化学用语正确的是( )
A. 二氧化碳的结构式:O—C—O
B. 原子核内有10个中子的氧原子:
O
C. F原子结构示意图:
D. MgCl2的电子式:

难度: 中等查看答案及解析
-
下列实验操作及现象和后面结论对应正确的是( )
选项
实验操作
现象
结论
A
将SO2通入酸性高锰酸钾溶液
高锰酸钾溶液紫色褪色
SO2具有漂白性
B
向某溶液中滴加KSCN溶液
溶液显红色
原溶液中有Fe3+无Fe2+
C
将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液
有白色沉淀生成
证明非金属性S>C>Si
D
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
中国是中草药的发源地,目前中国大约有12000种药用植物。从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是
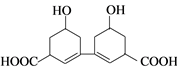
A. 该物质的熔点比同碳的烃分子熔点高
B. 分子式为C14H18O4
C. 1mol该有机物与足量的金属钠反应产生4molH2
D. 环上氢原子的一氯取代物5种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 molN2与4mol H2反应生成的NH3分子数为2NA
C. 1molFe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
难度: 困难查看答案及解析
-
饱和一元醇C5H12O3属于醇且能氧化为醛的同分异构体有几种
A. 4种 B. 5种 C. 6种 D. 8种
难度: 困难查看答案及解析
-
2013年1月我国大部分地区被雾霾笼罩,空气质量严重污染。PM 2.5
是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是( )。
A. 雾霾空气属于混合物
B. 微粒直径为2.5微米的细小颗粒物可形成胶体
C. 实施绿化工程,可以有效防治PM 2.5污染
D. PM 2.5表面积大,能吸附大量的有毒有害物质
难度: 中等查看答案及解析
-
下列有关物质的性质或应用正确的是
A. 单质硅用于制造芯片和光导纤维
B. 浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性
C. SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色
D. 30%的H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂
难度: 简单查看答案及解析
-
下列实验与对应示意图的关系正确的是
A
B
C
D
NaAlO2溶液中逐滴滴加盐酸至过量
AlCl3溶液中逐滴滴加氨水至过量
明矾溶液中逐滴滴加Ba(OH)2溶液至过量
澄清石灰水中缓慢通入CO2至过量
难度: 中等查看答案及解析
-
下列关子煤和石油的说法中正确的是
A. 由于石油中含有乙烯,所以石油裂解中乙烯的含量较高
B. 由于煤中含有苯,所以可从煤干馏的产品中分离得到苯
C. 石油没有固定的熔沸点,但其分馏产物有固定的熔沸点
D. 石油的裂解气、煤干馏得到的焦炉气都能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH
数目增多 ④c(OH-)增大 ⑤导电性增强⑥
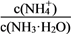 增大
增大A. ①②③ B. ①③⑤ C. ①③⑥ D. ②④⑥
难度: 困难查看答案及解析
-
下列溶液中粒子的物质的量浓度关系正确的是
A. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B. 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:
C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D. 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
在一定条件下某体积一定的密闭容器中发生的反应aA(g)+bB(g)
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
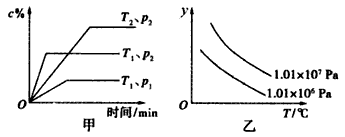
A. 平衡混合气的密度
B. 平衡混合气中B的百分含量
C. 平衡混合气的总物质的量
D. 平衡混合气的平均相对分子质量
难度: 困难查看答案及解析
-
下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的
选项
微粒组
加入试剂
发生反应的离子方程式
A
Na+、Fe3+、Cl-、I-
NaOH溶液
Fe3++3OH-=Fe(OH)3↓
B
K+、NH3·H2O、CO32-
通入少量CO2
2OH-+CO2=CO32-+H2O
C
H+、Fe2+、SO42-、Cl-
Ba(NO3)2溶液
SO42-+Ba2+=BaSO4↓
D
Na+、Al3+、Cl-、NO3-
少量澄清石灰水
Al3++3OH-=Al(OH)3↓
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
B. 向NH4HSO3溶液中加过量的NaOH溶液并加热:NH4++OH-
NH3↑+H2O
C. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
D. Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
制备新型高效水处理剂高铁酸钠(Na2FeO4)的主要反应为:2FeSO4+aNa2O2=2Na2FeO4+2Na2O+2Na2SO4+bX。下列说法中正确的是
A. 该反应中X物质为O2
B. 反应物Na2O2只作氧化剂
C. 该反应中发生氧化反应的过程只有FeSO4→Na2FeO4
D. 每生成l molNa2FeO4,反应过程中转移4 mol e-
难度: 困难查看答案及解析
-
锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电时,负极反应为:Zn+4OH–-2e–=Zn(OH)42-
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4·H2C2O4混合溶液。下列叙述错误的是
A. 阴极的电极反应式为Al3++3e-==Al B. 可选用不绣钢网作为阴极
C. 待加工铝质工件为阳极 D. 硫酸根离子在电解过程中向阳极移动
难度: 困难查看答案及解析
-
将Mg、Cu组成的26.4 g混合物投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96 L,向反应后的溶液中加入足量的4 mol/L的NaOH溶液,使金属离子完全沉淀。则形成沉淀的质量是
A. 36.6 g B. 43.2 g C. 46.8 g D. 59 g
难度: 困难查看答案及解析



