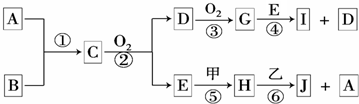
-
某校化学兴趣小组为研究铜丝与过量浓硫酸的反应及SO2的部分化学性质,进行如下实验.该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染.经过同学们的讨论以及老师的指导,该小组设计了图所示的装置并进行实验.
请回答下列问题:
(1)装置A中发生反应的化学方程式为______ CuSO4+SO2↑+2H2O
难度: 中等查看答案及解析
-
1.某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe3+、Ba2+、K+、OH-、Cl-、CO2-3、SO2-4.为了进一步确认,取样进行实验检测:
①取污水仔细观察,呈无色、透明、均一状态.
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失.
③用pH试纸测定污水的pH,试纸显深蓝色.
(1)由此可知,该污水中肯定含有的离子是______,肯定没有的离子是______,可能含有的离子是______.
(2)简述通过实验进一步确定溶液中可能存在离子的操作步骤及现象______.
2.实验室为化学兴趣小组的同学准备了四种红色溶液,它们分别可能是KMnO4酸性溶液、滴有酚酞的NaOH溶液、滴有石蕊的稀硫酸和品红溶液.另外还提供了常见的仪器和药品.为了培养同学们的创新精神和实践能力,只允许选用一种试剂对上述四种溶液加以鉴别.
(1)甲组同学选用了FeCl2溶液,试写出该组同学鉴别出NaOH溶液的有关离子方程式:______;
(2)乙组同学选用了Na2SO3溶液,他们直接能鉴别出来的溶液及对应的现象分别是______;
(3)丙组同学选用了一种试剂,一次性鉴别出上述四种溶液,他们选择的试剂可能是______.难度: 中等查看答案及解析
-
[选修2-化学与技术]合成氨的流程示意图如下:
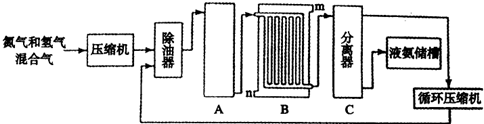
回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为______难度: 中等查看答案及解析
-
【选修3-物质结构与性质】
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4.Mn2+基态的电子排布式可表示为______,NO-3的空间构型为______ (用文字描述);
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.根据等电子原理,CO分子的结构式为______,1molCO2中含有的σ键数目为______;
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图1),a位置上Cl原子的杂化轨道类型为______,已知其中一种化合物的化学式为KCuCl3,另一种的化学式为______;
(4)用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积(如图2),边长为361pm,又知铜的密度为9.00g/cm3,则铜晶胞的体积是______cm3、晶胞的质量是______g,阿伏加德罗常数为______(列式计算);
(5)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是______.难度: 中等查看答案及解析
-
化合物A(C12H16O3)经碱性水解、酸化后得到B和C(C8H8O2).C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子.B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8%,含氢7.0%,核磁共振氢谱显示只有一个峰.
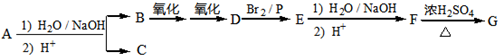
已知: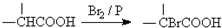
请回答下列问题:
(1)写出G的分子式:______.
(2)写出A的结构简式:______.
(3)写出F→G反应的化学方程式:______,该反应属于______(填反应类型).
(4)写出满足下列条件的C的所有同分异构体:______.
①是苯的对位二取代化合物;
②能与FeCl3溶液发生显色反应;
③不考虑烯醇()结构.
(5)在G的粗产物中,经检测含有聚合物杂质.写出聚合物杂质可能的结构简式(仅要求写出1种):______.难度: 中等查看答案及解析