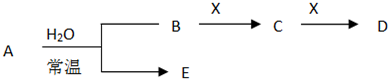-
X、Y、Z和R为原子序数依次递增的四种元素.其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素.下列说法不正确的是( )
A.127R-的核外含有54个电子
B.Y、Z、R的氢化物的稳定性逐渐减弱
C.有lmolY的单质与水发生反应则转移电子的物质的量为2mol
D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色难度: 中等查看答案及解析
-
生活中的某些问题,常涉及到化学知识,下列分析不正确的( )
A.冰箱中使用的含氟制冷剂泄漏后,会破坏臭氧层
B.Cl2和SO2都有漂白作用,都可以使有色棉布褪色
C.减少硫的氧化物和氮氧化物向空气中的排放,是防止酸雨形成的有效措施
D.严格地讲实验室使用排风扇是种不负责任的防污染手段,因为产生的有害气体没有得到转化或吸收难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.6.8g熔融的KHSO4中含有0.1NA个阳离子
B.0.5mol/L Na2CO3溶液中含有的CO32-数目小于0.5NA
C.25℃时,1 L pH=13的NaOH溶液中约含有NA个氢氧根离子
D.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA难度: 中等查看答案及解析
-
下列说法正确的是( )
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
B.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c (Na+)+c(H+)=c (S2-)+c (HS-)+c (OH-)
D.AgCl悬浊液中存在平衡:AgCl(s)⇌Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一种难溶的物质,可用CuSO4溶液和“另一种物质”在40°C~50°C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是( )
A.CuH既可做氧化剂又可做还原剂
B.另一种物质一定具有还原性
C.CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D.CuH在Cl2燃烧的化学方程式为:CuH+Cl2CuCl+HCl
难度: 中等查看答案及解析
-
下述实验不能达到预期实验目的是( )
序号 实验内容 实验目的 A 将2.5g CuSO4•5H2O溶解在97.5g 水中 配制质量分数为1.6%的CuSO4溶液 B 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 说明一种沉淀能转化为另一种溶解度更小的沉淀 C 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液和0.1mol•L-1 CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱 D 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
经研究发现具白蚁信息素的物质有:
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.下列说法正确的是( )
A.2,4-二甲基-1-庚烯与l-庚烯互为同分异构体
B.以上三种信息素均能使溴的四氯化碳褪色
C.以上三种信息素都是乙烯的同系物
D.家蚕信息素与1molBr2加成产物只有一种难度: 中等查看答案及解析