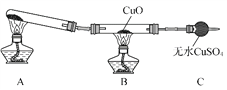
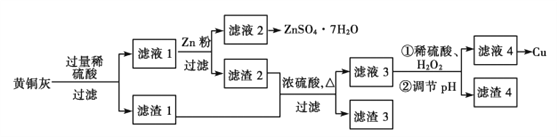
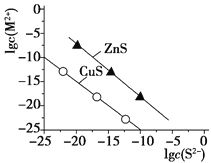
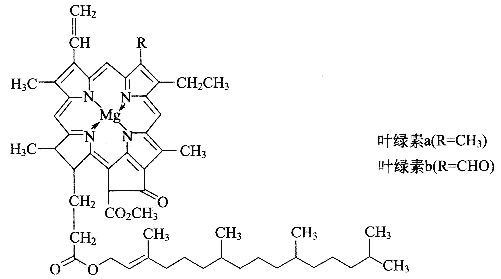
-
中华传统文化博大精深,其中涉及到很多的化学知识。下列有关说法不正确的是
A. 中国的圆珠笔头一直需要进口笔尖钢,2016年9月,中国太钢集团利用家常和面原理在钢水中加入添加剂试验成功,造出圆珠笔头,可完全替代进口,由此信息可知笔尖钢为合金,且具有良好的切削性
B. 古代染坊常用某种碱剂来精炼丝绸,碱剂不可能为烧碱
C. 《神农本草经》记载,麻黄能“止咳逆上气”,说明麻黄碱具有平喘功能,常常用于治疗气喘咳嗽
D. 《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物
难度: 中等查看答案及解析
-
有一种含氧杂环化合物,在合成有机材料和药品中有重要应用、其结构如下图所示。下列关于该有机物的说法不正确的是

A. 1mol该有机物最多能消耗4mol NaOH
B. 1mol该有机物与H2反应时,最多消耗6mol H2
C. 该有机物的苯环上的一氯代物有3种
D. 该分子所有原子可能处于同一平面上
难度: 中等查看答案及解析
-
2SO2(g)十O2(g)
2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. 在恒温、恒容条件下,达到平衡后继续加入少量SO3平衡将向正反应方向移动,所以SO3的体积百分数增大
难度: 中等查看答案及解析
-
仅用下表提供的玻璃仪器(自选非玻璃仪器)就能实现相应实验目的的是( )
选项
实验目的
玻璃仪器
A
分离硝酸钾和氯化钠混合物
烧杯、酒精灯、玻璃棒、分液漏斗
B
配制450 mL 2 mol·L-1氯化钠溶液
500 mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管
C
除去氢氧化铝胶体中的泥沙
漏斗(带半透膜)、烧杯、玻璃棒
D
从食盐水中获得NaCl晶体
坩埚、玻璃棒、酒精灯、泥三角
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业上通过电化学原理在铝片表面形成氧化膜来提高其抗腐蚀能力,工作原理如下图所示。列说法正确的是
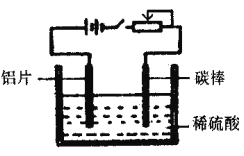
A. 碳棒可用任意金属代替,其作用是传递电流
B. 通电一段时间后,溶液的pH增大
C. 通电后电子被强制从碳棒流向铝片使铝表面形成氧化膜
D. 可通过调节滑动变阻器来控制氧化膜的形成速度
难度: 中等查看答案及解析
-
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断不正确的是( )
A. 甲通入硫酸铜溶液中无明显现象,但甲能与碱反应
B. 乙的摩尔质量为32g/mol则乙分子中可能含有极性键、非极性键
C. 若丙中含有第二周期ⅣA族的元素,则丙可能是甲烷的同系物
D. 若丁中各元素质量比跟甲中各元素质量比相同,则丁既可能表现氧化性也可能表现还原性
难度: 困难查看答案及解析
-
常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的一元酸HX溶液,pH的变化曲线如下图所示(溶液混合时体积的变化忽略不计).下列说法正确的是( )
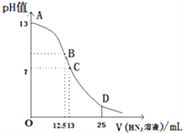
A. 在B点,离子浓度大小为 c(OH-)>c(H+)>c(Na+)>c(X-)
B. D点的溶液中c(H+)+c(HX)=c(X-)+c(OH-)
C. HX是弱酸,常温下其电离常数Ka=2.5×10-6
D. D点的溶液中有c(HX)-2c(H+)=2c(OH-)+c(X-)
难度: 困难查看答案及解析