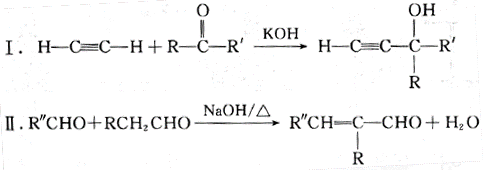
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a
B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物
D. 元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 简单查看答案及解析
-
化学与生产、生活、社会密切相关。下列说法中正确的是( )
A. 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒
B. “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适
C. 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰
D. 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
难度: 简单查看答案及解析
-
下列物质与其用途完全符合的有几项( )
①SiO2——太阳能电池 ②NH3——制硝酸 ③NaCl——制纯碱 ④Al2O3——焊接钢轨
⑤NaClO——消毒剂 ⑥MgO——耐火材料 ⑦H2SO4——制炸药 ⑧Na2CO3——制水泥
A. 4 B. 5 C. 6 D. 7
难度: 简单查看答案及解析
-
我国学者成功发现了新一类水分解产氢催化剂:通过调控三氧化钨(WO3)局部原子结构,制备出深蓝色钨氧化物(WO2.9),该种钨的氧化物能高效而快速地催化水分解产生H2。下列有关说法正确的是( )

A. WO3和WO2.9是同分异构体
B. 由WO3制备WO2.9的过程发生了氧化还原反应
C. 18gH2O在WO2.9的高效催化下产生H2体积为22.4L
D. 利用这种新型催化剂分解水的同时可放出热量
难度: 简单查看答案及解析
-
下列实验能获得成功的是( )
选项
实验目的
实验步骤
A
比较CH3COOH和H2CO3酸性强弱
测同浓度的Na2CO3、CH3COONa溶液的pH
B
比较S和Si非金属性强弱
向Na2SiO3溶液中通入SO2出现浑浊
C
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
D
探究蔗糖水解的产物中是否含有葡萄糖
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示。下列有关说法错误 的是( )

A. A极电极反应式为:
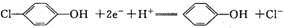
B. B极电极反应式为:
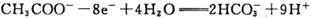
C. 溶液中的阴离子由A极向B极移动
D. 该微生物电池在高温条件下无法正常工作
难度: 简单查看答案及解析
-
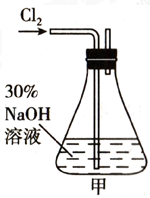
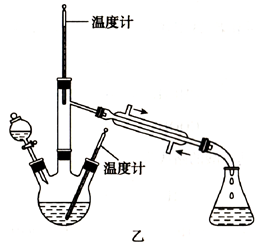
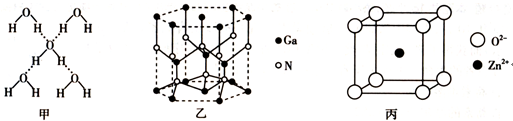
对下列实验装置图,有关说法不正确的是( )
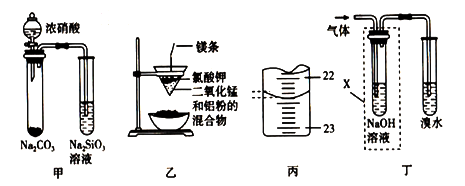
A. 图甲根据实验现象证明酸性强弱:硝酸>碳酸>硅酸
B. 图乙制备金属锰
C. 图丙滴定管中溶液的液面读数为22.40mL
D. 图丁检验乙醇与浓硫酸加热至170℃产生的气体,必须有除杂装置X
难度: 简单查看答案及解析
-
已知丁基(—C4H9)有四种结构,某烃的结构简式为
 ,该烃可能的结构有( )
,该烃可能的结构有( )A. 16种 B. 14种 C. 12种 D. 10种
难度: 中等查看答案及解析
-
用石墨作电极电解0.1mol
L-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( )
A. 在电解后的溶液中注入一定量的盐酸可以使溶液恢复到原始状态
B. 在电解质溶液中通入标准状况下4.48L的氯化氢气体并注入0.1mol的水可以使溶液恢复到原始状态
C. 阴极产生的气体的物质的量是阳极产生气体的物质的量的0.75倍
D. 阳极产生的气体的平均摩尔质量为58g/mol
难度: 简单查看答案及解析
-
下列反应在一定条件下可以实现的是( )
①酸性氧化物与碱反应 ②有单质参加的非氧化还原反应
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
A. 1个 B. 2个 C. 3个 D. 4个
难度: 简单查看答案及解析
-
阿伏加德罗常数用NA表示,下列叙述中正确的是( )
①标准状况下,22.4L乙醇中含有的氧原子数目为NA
②6.4g的34S2和34S8混合物中,含硫原子总数为0.2NA
③12g金刚石含有的共价键数为2NA
④10mL质量分数为98%的H2SO4,加水至100mL,H2SO4的质量分数大于9.8%
⑤含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑦1L含NA个NH3
H2O的氨水,其浓度为1mol
L-1
A. ②③④ B. ③④⑤ C. ④⑥⑦ D. ①②⑤
难度: 简单查看答案及解析
-
根据键能数据估算CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
化学键
C—H
C—F
H—F
F—F
键能/(kJ
mol-1)
414
489
565
155
A. -485 kJ
mol-1 B. +485 kJ
mol-1 C. +1940 kJ
mol-1 D. -1940 kJ
mol-1
难度: 简单查看答案及解析
-
下列解释物质用途或现象的方程式不正确的是( )
A. 铝热反应用于焊接钢轨:2Al+Fe2O3
Al2O3+2Fe
B. 汽车尾气中发生的催化转化反应:2NO+2CO
N2+2CO2
C. 燃煤时加入石灰石减少SO2的排放:2CaCO3+2SO2+O2
2CaSO3+2CO2
D. 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+ CO32-
CaCO3+ SO42-
难度: 简单查看答案及解析
-
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
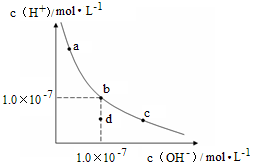
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
难度: 中等查看答案及解析
-
下列各项内容中排列顺序正确的是
A. 相同物质的量浓度的下列溶液中NH4+的浓度: (NH4)2SO4> NH4Cl > NH4HCO3
B. 微粒半径: K+> S2-> F-
C. 给出质子的能力:CH3COOH >C2H5OH > H2O
D. 氢化物的沸点: HF > HCl > HBr
难度: 简单查看答案及解析
-
在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)
N2O4(g) △H<0]:
容器
物质
起始浓度/(mol
L-1)
平衡浓度/(mol
L-1)
Ⅰ
N2O4
0.100
0.040
NO2
0
0.120
Ⅱ
N2O4
0
0.0142
NO2
0.100
0.0716
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率
(N2O4)>(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率
(Ⅰ)<
(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
难度: 中等查看答案及解析