-
下列说法中,正确的是( )
A.
三氧化硫的水溶液能导电,所以三氧化硫是电解质
B.自由移动离子数目多的电解质溶液导电能力一定强
C.NaHSO4在水溶液及熔融状态下均可电离出Na+、H+、SO42-
D.NH3属于非电解质,但其水溶液能够导电
难度: 中等查看答案及解析
-
反应A+3B
2C+2D,在四种不同情况下的反应速率分别为:①v(A)=0.15 mol·L-1·s-1;②v(B)=0.6 mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1。该反应进行的最快的是( )
A.① B.④ C.①④ D.②③
难度: 中等查看答案及解析
-
X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1,H—H、O=O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
难度: 中等查看答案及解析
-
已知4NH3+5O2
4NO+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol·L-1·min-1]表示,则正确的关系是( )
A.
v(NH3)=v(O2) B.
v(O2)=v(H2O)
C.
v(NH3)=v(H2O) D.
v(O2)=v(NO)
难度: 中等查看答案及解析
-
下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是( )
①pH=0的盐酸 ②0.1mol·L-1的盐酸
③0.01mol·L-1的NaOH溶液 ④pH=11的NaOH溶液
A.1∶10∶100∶1000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
难度: 中等查看答案及解析
-
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡: CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol
·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
已知氢氟酸在水溶液中建立如下电离平衡:HF
H++F-,如只改变一个条件一定可以使c(HF)/c(H+)减小的是( )
A.通HCl(g) B.加入少量KF(s)
C.加入少NaOH(s) D.通入少量HF(g)
难度: 中等查看答案及解析
-
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
难度: 中等查看答案及解析
-
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组
成的电解液。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.电池正极反应式为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子个数为1.204×1023
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.若H2O2分解产生1 mol O2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2 ⇌2NH3达到平衡时,3v正(H2)=2v逆(NH3)
难度: 中等查看答案及解析
-
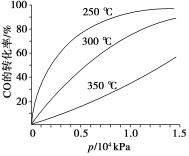
已知可逆反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.
 B.
B.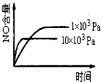 C.
C.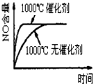 D.
D.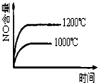
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是( )
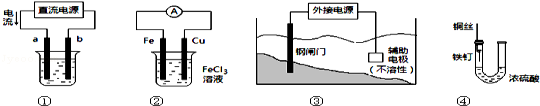
A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的正极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
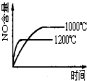
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
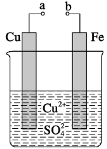
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用
导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电流正、负极,电压足够大时,Cu2+向铜电极移动
难度: 困难查看答案及解析
-
已知某密闭容器中存在下列平衡: CO(g)+H2O(g)
CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如右图所示。下列说法错误的是( )
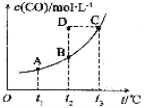
A.平衡状态A与C相比,平衡状态A的c(CO)较小
B.在t2时,D点的反应速率:ν(逆)>ν(正)
C.反应CO(g)+H2O(g) ⇌ CO2(g)+H2(g)的△H>0
D.若t1 、t2时的平衡常数分别为K1、K2,则K1<K2
难度: 困难查看答案及解析