-
某学生的实验报告所列出的下列数据中合理的是( )
A. 用10mL量筒量取7.13mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用广泛pH试纸测得某溶液的pH为2.3
D. 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
难度: 简单查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是( )
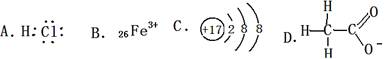
难度: 简单查看答案及解析
-
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A. H+的物质的量 B. 醋酸的电离常数
C. 中和时所需NaOH的量 D. CH3COOH的物质的量
难度: 简单查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
难度: 简单查看答案及解析
-
关于强弱电解质及非电解质的组合完全正确的是( )
A
B
C
D
强电解质
NaCl
H2SO4
CaCO3
HNO3
弱电解质
HF
BaSO4
HClO
CH3COOH
非电解质
Cl2
CS2
C2H5OH
CaO2
难度: 简单查看答案及解析
-
等体积的下列各溶液中,阴离子的总浓度最大的是( )
A.0.2mol·L-1Na2CO3溶液 B.0.1mol·L-1Ba(OH)2溶液
C.0.2mol·L-1CH3COOH溶液 D.0.2mol·L-1的氨水
难度: 简单查看答案及解析
-
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述中不正确的是( )
A.此时水的离子积KW=1×10-14
B.水电离出的c(H+)=1×10-10mol·L-1
C.水的电离程度随温度升高而增大
D.c(Na+)=c(
)
难度: 简单查看答案及解析
-
下列各组离子,在指定的环境中一定能大量共存的是( )
A.在pH为7的溶液中:Ag+、K+、
、Cl-
B.在能使pH试纸变深蓝色的溶液中:Na+、S2-、
、
C.在加入铝粉能产生H2的溶液中:
、Fe2+、
、
D.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Mg2+、Cl-、I-
难度: 简单查看答案及解析
-
25℃时,向10mLpH=12的某碱溶液中加入10mLpH=2的盐酸,充分反应后滴入石蕊试液,溶液显蓝色,则此碱一定是( )
A.弱碱 B.一元强碱 C.多元强碱 D.任何强碱
难度: 简单查看答案及解析
-
下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终一定能得到纯净物的是( )
A.向FeSO4溶液中通入过量Cl2
B.向NaHCO3溶液中加入一定质量的Na2O2粉末
C.向NaI和NaBr混合溶液中通入过量Cl2
D.向NaOH溶液中加入过量AlCl3
难度: 简单查看答案及解析
-
下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是( )
化学式
AgCl
Ag2SO4
Ag2S
AgBr
AgI
溶度积
1.8×10-10
1.4×10-5
6.3×10-50
7.7×10-13
8.5×10-16
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
难度: 简单查看答案及解析
-
对于相同体积的K2CO3溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中
的物质的量浓度相同,则c1和c2的关系是( )
A.c1=c2 B.c1>c2 C.c1≥c2 D.c1<c2
难度: 简单查看答案及解析
-
物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中pH最大的是( )
A.Na2CO3溶液 B.NH4HCO3溶液 C.NaHCO3溶液 D.NaHSO4溶液
难度: 简单查看答案及解析
-
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是( )
A. 若溶液中c(A-)=c(Na+),则溶液一定呈中性
B. 溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C. 若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D. 若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
难度: 简单查看答案及解析
-
室温时,将xmLpH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
难度: 简单查看答案及解析
-
有人建议用AG表示溶液的酸度,AG的定义为AG=lg
,下列表述正确的是( )
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,若溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式化为AG=2(7-pH)
难度: 简单查看答案及解析
