-
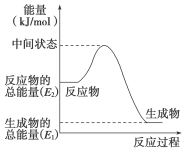
下列各图中,表示正反应是吸热反应的是

难度: 简单查看答案及解析
-
已知反应3A(g)+B(g)
C(s)+4D(g)+Q,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是
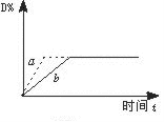
①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
A.①② B.①③ C.②③ D.③④
难度: 中等查看答案及解析
-
一定温度下,可逆反应A2(g)+B2(g)
2AB(g)达到平衡状态的标志是
A.单位时间内生成 n mol A2,同时生成 n mol AB
B.体系内的总压不随时间变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成 n mol A2的同时,生成n mol B2
难度: 中等查看答案及解析
-
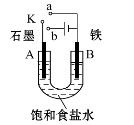
下列事实不能用勒夏特列原理解释的是:
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由H2(g)、I2(g)、HI(g)组成的平衡体系,加压后颜色加深
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
难度: 中等查看答案及解析
-
在2A﹢B
2C﹢D反应中,表示该反应速率最快的是
A.v(A)=0.8mol·L-1·s-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.6mol·L-1·s-1 D.v(D)=0.5mol·L-1·s-1
难度: 中等查看答案及解析
-
下列属于强电解质的是
A.Cu B.CH3COONH4 C.CH3COOH D.NH3·H2O
难度: 中等查看答案及解析
-
常温下,下列溶液中c(H+)最小的是
A.c(H+)=1×10-3mol·L-1 B.pH=3的CH3COOH溶液
C.c(OH-)=1×10-11mol·L-1 D.pH=4的H2SO4溶液
难度: 中等查看答案及解析
-
水的电离平衡为H2O
H+﹢OH-,△H>0,下列叙述不正确的是
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中滴入稀醋酸,c(H+)增大
D.向水中加入少量固体NaClO,平衡逆向移动
难度: 中等查看答案及解析
-
下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是

A.①②③④⑤ B.③②①⑤④
C.⑤①③②④ D.⑤②①③④
难度: 中等查看答案及解析
-
对于反应2X(g) + Y(g)
2Z(g),K表示平衡常数,下列说法正确的是
A.当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大
B.随着反应正向进行,Z的浓度不断增大,X、Y的浓度不断减小,平衡常数不断增大
C.温度发生变化,上述反应的K值也发生变化
D.可逆反应达到平衡时,逆反应便立即停止了
难度: 中等查看答案及解析
-
下列叙述正确的是
A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B.溶液中c(H
)越大,pH也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
难度: 中等查看答案及解析
-
为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG==lgc(H+)/c(OH—)。已知常温下某无色溶液的AG==12,则此溶液中大量共存的离子组是
A.Na+ 、AlO2— 、K+ 、NO3—
B.MnO4—、K+ 、SO42— 、 Na+
C.Mg2+ 、 SO42—、 HCO3— 、Na+
D.NH4+ 、NO3—、 Al3+ 、Cl—
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述中正确的是
A.溶质的物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者大于后者
B.在CH3COONa溶液中c (CH3COO-) > c(Na+) > c(OH-) > c(H+)
C.Na2CO3、NaHCO3两种盐的溶液中,离子种类相同
D.常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸
难度: 中等查看答案及解析
-
在100mL H
SO
与CuSO
的混合液中,用石墨作电极电解,两极上均收集到2.24L气体(标准状况),则原混合溶液中Cu
的物质的量浓度为
A.1 mol·L
B.2 mol·L
C.3 mol·L
D.4 mol·L
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq) + CH3COOH(aq) = CH3COONa(aq) + H2O(l);△H = -57.4kJ·mol-1
B.已知C(石墨,s)= C(金刚石,s);△H>0,则石墨比金刚石稳定
C.已知反应2H2(g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1,则H2的燃烧热为571.6kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
难度: 中等查看答案及解析
-
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO
+2Ag+2NaCl=Na
Mn
O
+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是
A.正极反应式:Ag+Cl
-e
=AgCl
B.每生成1 mol Na
Mn
O
转移2 mol电子
C.Na
不断向“水”电池的负极移动
D.AgCl是还原产物
难度: 中等查看答案及解析
-
下列说法正确的是
A.酚类和醇类具有相同的官能团,因而具有相同的化学性质
B.含有羟基的化合物属于醇类
C.羟基跟链烃基直接相连的化合物属于醇类
D.分子内含有苯环和羟基的化合物都属于酚类
难度: 中等查看答案及解析
-
下列有机物实际存在且命名正确的是
A.2,2-二甲基丁烷 B.2-甲基-5-乙基-1-己烷
C.3-甲基-2-丁烯 D.3,3-二甲基-2-戊烯
难度: 中等查看答案及解析