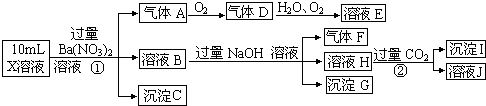
-
下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则氢气的燃烧热为-285.8kJ/mol
B.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4kJ/mol
D.已知2C(s)+O2(g)═2CO(g)△H1;2C(g)+2O2(g)═2CO2(g)△H2,则△H1>△H2难度: 中等查看答案及解析
-
某溶液能使甲基橙变红,下列各组离子能在该溶液中大量共存的是( )
A.Fe2+、K+、NO3-、SO42-
B.Cu2+、Mg2+、NO3-、SO42-
C.Fe3+、Na+、Cl-、C6H5O-
D.Fe3+、K+、I-、Cl-难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,22.4LCO2中含有NA个CO2分子
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子
C.1mol羟基中含有9NA个电子
D.SiO2晶体中,每摩硅原子可形成2NA个共价键难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向100mL3mol/LFeBr2溶液中通入标准状况下4.48LCl2;
B.体积和物质的量浓度相同的NaHCO3和Ba(OH)2溶液相混合:HCO3-+OH-+Ba2+═BaCO3↓+H2O
C.以石墨为电极电解的MgCl2溶液:
D.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体Fe3++3H2OFe(OH)3↓+3H+
难度: 中等查看答案及解析
-
以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是( )
A.KMnO4
B.NaNO2
C.FeCl3
D.HNO3难度: 中等查看答案及解析
-
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则( )

A.N4是一种新型化合物
B.1molN4气体转化为N2时要吸收748kJ能量
C.N4是N2的同位素
D.1molN4气体转化为N2时要放出724kJ能量难度: 中等查看答案及解析
-
酸性高锰酸钾能将醇氧化生成一系列产物,反应中KMnO4被还原为Mn2+,用0.60mol•L-1的酸性高锰酸钾溶液滴定20.0mL0.50mol•L-1的乙二醇溶液,当用去20.0mL高锰酸钾溶液时,再滴加1滴高锰酸钾溶液时,溶液刚好呈紫红色,振荡后不褪色.则乙二醇的氧化产物为( )
A.OHC-CHO
B.HOOC-COOH
C.HOOC-CHO
D.CO2难度: 中等查看答案及解析
-
一定质量的铜、铝混合物与一定体积硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,将所产生沉淀取出,余下溶液加水稀释至600ml,此时所得溶液的物质的量浓度为( )
A.1mol/L
B.0.5mol/L
C.1.2mol/L
D.2mol/L难度: 中等查看答案及解析