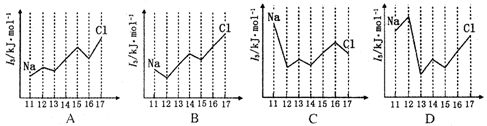
-
下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和S的中心原子均为sp2杂化
答
难度: 中等查看答案及解析
-
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的汽化
难度: 中等查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数) ( )
A.124 g P4含有P—P键的个数为4NA
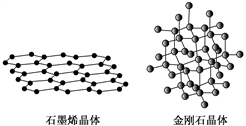
B.12 g石墨中含有C—C键的个数为3NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSiO2中含Si—O键的个数为2NA
难度: 简单查看答案及解析
-
下列各种基态原子的核外电子排布式中,正确的是( )。
A. 1s22s12p2 B. 1s22s22p33s1
C. 1s22s22p63s14s1 D. 1s22s22p63s23p64s1
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A. 冰融化时,分子中H—O键发生断裂
B. 原子晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D. 在晶体中只要有阳离子就一定有阴离子
难度: 中等查看答案及解析
-
下列分子中,各原子均处于同一平面上的是( )
A.NH3 B.CCl4 C.H3O+ D.CH2O
难度: 中等查看答案及解析
-
下列说法正确的是 ( )。
A.凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型
B.在SCl2中,中心原子S采取sp杂化轨道成键
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
难度: 中等查看答案及解析
-
金属晶体的堆积密度大,原子配位数高,能充分利用空间的原因是( )
A. 金属原子的价电子数少
B. 金属晶体中有自由电子
C. 金属原子的原子半径大
D. 金属键没有饱和性和方向性
难度: 简单查看答案及解析
-
下列离子晶体中,熔点最低的是( )
A.NaCl B.KCl C.CaO D.MgO
难度: 中等查看答案及解析
-
碳酸亚乙烯酯结构如右图所示。下列有关该物质的说法正确的是( )
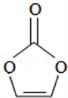
A. 分子中含6个σ键
B. 分子式为C3H2O3
C. 分子中只有极性键
D. 8.6 g该物质完全燃烧得到6.72 L CO2
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. NH3比CH4更容易液化
B. 形成氢键能够使物质熔沸点升高
C. 稀有气体很稳定,是因为键能很大
D. 冰的密度比干冰的密度大
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A. C、N、O三种元素第一电离能从大到小的顺序是 O>N>C
B. 处于激发态的原子电子排布也遵循能量最低原理、洪特规则和泡利原理
C. 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
D. 基态到激发态产生的光谱是吸收光谱
难度: 简单查看答案及解析
-
下列现象中,其原因与氢键存在无关的是( )
A. 水的熔沸点比较高
B. CH4、SiH4、GeH4、SnH4熔点逐渐升高
C. DNA的双螺旋结构
D. 邻位羟基苯甲醛的沸点比对位羟基苯甲醛沸点低
难度: 中等查看答案及解析
-
下面有关晶体的叙述中,不正确的是( )
A. 金属原子密置层原子在三堆空间里堆积可得六方最密堆积和面心立方最密堆积
B. 氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个
C. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
难度: 简单查看答案及解析
-
下列对各组物质性质的比较中,正确的是( )
A. 硬度:Li>Na>K
B. 熔点:金刚石>晶体硅>石英
C. 第一电离能:Na<Mg<Al
D. 空间利用率:体心立方<六方密堆积<面心立方
难度: 中等查看答案及解析