-
化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A. “地沟油”经过加工处理后,可以用于制肥皂和生物柴油
B. 纤维素属于多糖类物质,但不能作人类的营养物质
C. 汽车尾气中的氮氧化物是由空气中的N2与O2在高温或放电条件下生成的
D. 古有“青蒿一握,以水二升渍,绞取汁”,今用乙醚从黄花蒿中可提取青蒿素是利用氧化还原反应原理
难度: 中等查看答案及解析
-
下列化学用语或模型图正确的是( )
A. HClO的结构式:H-Cl-O B. Na2O2的电子式:Na
Na
C. CO2的比例模型:
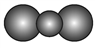 D. 14C的原子结构示意图:
D. 14C的原子结构示意图: 难度: 中等查看答案及解析
-
下列有关实验操作、现象和结论都正确的是( )
操 作
现 象
结 论
A
向煤炉中灼热的煤炭上洒少量水
产生淡蓝色火焰,煤炭燃烧更旺
加少量水后,可使煤炭燃烧放出更多的热量
B
向某溶液中滴加BaCl2溶液
生成白色沉淀
原溶液中一定有SO
C
向某无色溶液中滴加氯水和一定量的CCl4,振荡、静置
下层溶液显紫红色
原溶液中有I-
D
滴加稀NaOH溶液,并将湿润的红色石蕊试纸置于盛放溶液的试管口
试纸不变蓝
原溶液中一定无NH
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
从菌陈蒿提取出来的对羟基苯乙酮(
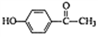 )可用于制造利胆药。下列有关对羟基苯乙酮的说法错误的是( )
)可用于制造利胆药。下列有关对羟基苯乙酮的说法错误的是( )A. 分于式为C8H8O2 B. 分子中的碳、氧原子可能都处于同一平面
C. 能与氢气发生加成反应 D. 含有苯环的羧酸类同分异构体有3种
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,W、Z同主族。X2-与Y+的电子层结构相同,Z的单质可用作太阳能电池的光电转换材料。下列说法错误的是( )
A. 离子半径:X2->Y+
B. 简单氢化物的沸点:H2X>ZH4
C. X与Y形成的两种二元化合物中,阴、阳离子数之比均为1∶2
D. 氢元素与W、X形成的相对分子质量最小的酸分子式为H2WX3
难度: 中等查看答案及解析
-
如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( )
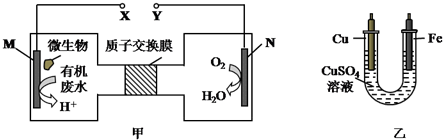
A.H+透过质子交换膜由左向右移动
B.铜电极应与Y相连接
C.M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,则铁电极增重16g
难度: 困难查看答案及解析
-
25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如右图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是

A. 根据图示可计算出Ksp(Ag2CO3)=9×10-9
B. 向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C. 反应Ag2CO3(s)+2Cl-(aq)
2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108
D. 在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀
难度: 中等查看答案及解析