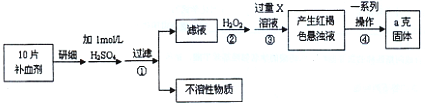
-
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A.电解MgC12饱和溶液,可制得金属镁
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.明矾水解形成的A1(OH)3胶体能吸附水中悬浮物,可用于水的净化难度: 中等查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O难度: 中等查看答案及解析
-
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2.有关它们的叙述 ①离子半径Na+>N3->H+;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构.其中正确的是( )
A.②③④⑤
B.①③⑤
C.②④
D.③难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配制1.00 L,1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.电解58.5 g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠难度: 中等查看答案及解析
-
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声同时产生白色烟雾.撞击时发生的化学方程式为:5KClO3+6P=3P2O5+5KCl,下列有关叙述正确的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为6:5
B.上述反应中消耗62gP时,转移电子的物质的量为15mol
C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
D.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)难度: 中等查看答案及解析
-
室温下,下列各组离子在给定条件下一定能大量共存的是( )
A.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
B.在pH=12的溶液中:ClO-、SO32-、Na+、K+
C.c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br-
D.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO-、I-难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温下,23 g NO2含有NA个氧原子
B.1 mol Cl2与足量的铁反应,转移的电子数为3NA
C.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
D.用惰性电极电解硫酸铜溶液,若生成1 mol O2,则转移电子数为4NA难度: 中等查看答案及解析
-
下列离子反应方程式正确的是( )
A.用澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
C.将金属钠加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
D.碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O难度: 中等查看答案及解析
-
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )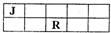
A.J和氢组成的化合物分子有多种
B.工业上不用电解M和T组成的化合物来制备M
C.R、T两元素的气态氢化物中,R的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4难度: 中等查看答案及解析
-
已知可逆反应X(g)+Y(g)⇌Z(g)(未配平).温度为T时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
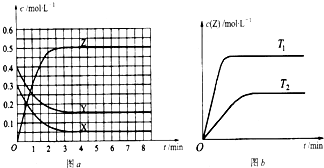
A.发生反应时,各物质的反应速率大小关系为:v(X)=v(Y)=2v(Z)
B.图a中反应达到平衡时,Y的转化率为37.5%
C.T℃时,该反应的平衡常数为33.3
D.该反应正反应的反应热△H<0难度: 中等查看答案及解析
-
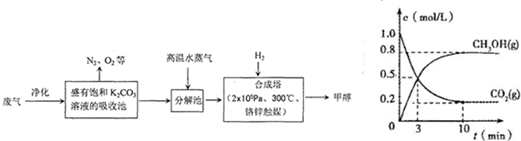
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
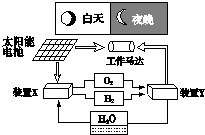
A.该系统中只存在3种形式的能量转化
B.装置X能实现燃料电池的燃料和氧化剂再生
C.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化难度: 中等查看答案及解析
-
下列各溶液中,物质的量浓度关系正确的是( )
A.在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
B.常温下,10 mL 0.01 mol•L-1HCl溶液与10 mL 0.01 mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.0.1 mol•L-1的KAl(SO4)2溶液中:c(SO42-)>c(Al3+)>c(OH-)>c(H+)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数值分别为:
下列有关叙述错误的是( )t℃ 700 800 830 1000 1200 K 1.67 1.11 1.00 0.60 0.38
A.该反应的化学方程式是:CO(g)+H2O(g)⇌CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态
D.若平衡浓度关系符合=
,可判断此时温度是1000℃
难度: 中等查看答案及解析
-
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液pH一定为14-a
B.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)难度: 中等查看答案及解析