-
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2)
B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne)
D.p(H2)>p(Ne)>p(O2)难度: 中等查看答案及解析
-
溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.是否能通过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定难度: 中等查看答案及解析
-
同温同压下有两份质量相同的O2和O3两种气体,关于它们的叙述不正确的是( )
A.氧元素的质量比是1:1
B.氧原子个数比是1:1
C.体积比是2:3
D.分子个数之比是3:2难度: 中等查看答案及解析
-
有一空瓶的质量为W1 g,向该瓶充入氧气后的质量为W2g,在相同条件下充入某一单质气体,其质量为W3g,则此单质气体的摩尔质量为( )
A.×32
B.×32
C.×32g•mol-1
D.×32g•mol-1
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.氧化还原反应的本质是元素化合价的升降
B.氧化还原反应一定有氧元素参加
C.氧化反应一定先于还原反应
D.发生氧化反应的物质也可能同时发生还原反应难度: 中等查看答案及解析
-
下列物质的体积约为22.4L的是( )
A.标准状况下1molH2O
B.20℃、101kPa时36.5gHCl
C.标准状况下80gCuO
D.标准状况下0.4molH2和0.6molO2的混合气难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数,下列判断正确的是( )
A.在18g18O2中含有NA个氧原子
B.标准状况下,22.4L空气含有NA个单质分子
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1难度: 中等查看答案及解析
-
将VLHCl气体( 标准状况)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为( )
A.mol/L
B.mol/L
C.mol/L
D.mol/L
难度: 中等查看答案及解析
-
能在水溶液中大量共存的一组离子是( )
A.SO32-、Cl-、Na+、ClO-
B.Ag+、Fe3+、Cl-、SO42-
C.K+、Na+、NO3-、MnO4-
D.Al3+、Mg2+、SO42-、CO32-难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.氯化亚铁溶液中通入少量氯气Fe2++Cl2=Fe3++2Cl-
B.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2═Fe3++Br2+4Cl-
C.向碳酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-=NH3•H2O
D.等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O难度: 中等查看答案及解析
-
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应;石灰石与盐酸难度: 中等查看答案及解析
-
P单质在反应4P+3KOH+3H2O═3KH2PO2+PH3中的变化是( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原难度: 中等查看答案及解析
-
下列实验中所选用的仪器正确的是( )
A.用200mL量筒量取5.2mL稀硫酸
B.用托盘天平称量11.7g氯化钠固体
C.用瓷坩埚灼烧纯碱
D.用50mL烧杯配制100g质量分数为5%的食盐水难度: 中等查看答案及解析
-
下列依据实验目的所设计的实验操作中正确的是( )
A.检验NaCl中含有Na2CO3,加水溶解
B.鉴别NaCl和Na2CO3溶液,加酚酞试液
C.除去CaO中的CaCO3,加足量稀盐酸
D.除去CO2中少量的CO,通入O2,点燃难度: 中等查看答案及解析
-
把VL含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A.mol•L-1
B.mol•L-1
C.mol•L-1
D.mol•L-1
难度: 中等查看答案及解析
-
已知溶质质量分数为96%的酒精溶液的物质的量浓度为16.6mol•L-1,试判断48%的酒精溶液的物质的量浓度(已知酒精的密度小于1)( )
A.大于8.3
B.等于8.3
C.小于8.3
D.无法确定难度: 中等查看答案及解析
-
当光束通过下列分散系:①尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到有丁达尔现象的是( )
A.①②
B.②③
C.①④
D.②④难度: 中等查看答案及解析
-
在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为( )
A.mol-1
B.mol-1
C.8nmol-1
D.4nmol-1难度: 中等查看答案及解析
-
下列叙述与胶体的性质无关的是( )
A.同一支钢笔使用不同品牌墨水时,容易发生堵塞现象
B.当日光从窗隙射入暗室时,可观察到一束光线
C.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
D.肾功能衰竭等疾病引起的尿毒症,可利用血液透析进行治疗难度: 中等查看答案及解析
-
下列说法正确的是( )
A.摩尔质量就等于物质的式量
B.摩尔质量就是物质式量的6.02×1023倍
C.HNO3的摩尔质量是63g
D.硫酸和磷酸的摩尔质量相等难度: 中等查看答案及解析
-
碳酸钠俗名纯碱或苏打,在外观上与食盐相似,可以作家用洗涤剂,如清洗厨房用具的油污等.下列不能将加碘食盐和碳酸钠区别开的试剂或用品是( )
A.食醋
B.淀粉
C.pH试纸
D.酚酞试液难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.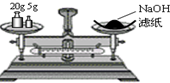 称量氢氧化钠固体
称量氢氧化钠固体
B. 分离柴油和水
分离柴油和水
C.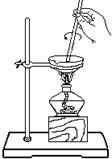 把饱和食盐水中的食盐提取出来
把饱和食盐水中的食盐提取出来
D. 分离两种互溶但沸点相差较大的液体混合物
分离两种互溶但沸点相差较大的液体混合物 难度: 中等查看答案及解析
-
配制100ml 2.0mol/L NaCl溶液时,下列情况中会导致最终浓度偏大的是( )
A.定容时,不小心加水超过了刻度线后,用胶头滴管吸出部分溶液至刻度线
B.容量瓶使用前未干燥
C.转移溶液后,烧杯没有洗涤
D.在称量NaCl固体时,天平指针偏左难度: 中等查看答案及解析
-
同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是3:2:1,则三溶液中氯离子的物质的量浓度之比为( )
A.3:4:3
B.1:2:3
C.1:1:1
D.6:3:2难度: 中等查看答案及解析
-
若某溶液中有Fe2+、Cl-和I-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是( )
A.Cl2
B.KMnO4
C.FeCl3
D.HCl难度: 中等查看答案及解析