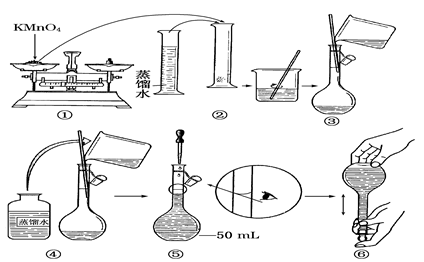
-
欧盟国家将从今年起禁用水银温度计,因为它在使用中易破碎,泄漏水银而危害人体健康,水银属于( )
A.化合物 B.混合物 C.单质 D.氧化物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是 ( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1mol/L的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1molNa被完全氧化
生成Na2O2,失去个2NA电子
难度: 中等查看答案及解析
-
对相同状况下的12C18O和14N2两种气体,下列说法正确的是 ( )
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等 D.若体积相等,则密度相等
难度: 中等查看答案及解析
-
将淀粉—KI混合液装在半透膜中,浸泡在盛蒸馏水的烧杯中一段时间后,某学生取烧杯中液体滴加几滴试剂便立即报告老师说:这个半透膜袋已经破损了,老师肯定了他的做法。这位学生所滴的试剂及观察到的现象是 ( )
A.滴两滴碘水显蓝色 B.滴淀粉试液显蓝色
C.滴入氯水一淀粉试液显蓝色 D.滴AgNO3,溶液出现黄色沉淀
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是 ( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O
AlO2-+4NH4++2H2O
B.澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-
CaCO3↓+H2O
C.氨水中通入过量二氧化碳:2NH3•H2O+CO2
CO32-+2NH4++H2O
D.溴化亚铁溶液中通入少量氯气:2Fe2++Cl2
2Fe3++2Cl-
难度: 中等查看答案及解析
-
卫生部发生公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )

A.CaO2具有氧化性,对面粉可能具有漂白作用
B.CaO2中阴阳离子的个数比为1: 1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2===2CaCO3+O2
难度: 中等查看答案及解析
-
有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是 ( )
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3-
C.Cl-、NO3-、SO42- D.AlO2-、MnO4-、SO42-
难度: 困难查看答案及解析