-
化学与人类生活、社会可持续发展密切相关。下列有关说法正确的是
①高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害
②374℃、2.2×104 kPa时,水与CO2发生“水热反应”生成有机物,该反应是放热反应
③PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重
④易降解的生物农药更适合于在未来有害生物综合治理中的应用
⑤过度使用尿素[CO(NH2)2]会使土壤碱化,可用石灰加以改良
A.①②⑤ B.①③④ C.②④⑤ D.①③⑤
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.次氯酸的结构式:H—Cl—O
B.质子数为53、中子数为72的碘原子:125 53I
C.对硝基苯酚的结构简式:
D.Na+的结构示意图:
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaHCO3溶液:K+、Al3+、NO3-、Cl-
B.0.1 mol·L-1Fe(NO3)3溶液:K+、NH4+、S2-、SCN-
C.能使甲基橙变红的溶液:Ca2+、Na+、ClO-、Cl-
D.0.1 mol·L-1的NaAlO2溶液:K+、Na+、SO42-、CO32-
难度: 简单查看答案及解析
-
右图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是

A.该反应的热化学方程式为:2NH3
N2+3H2 ΔH =-92 kJ·mol-1
B.正反应的活化能大于逆反应的活化能
C.a曲线是未加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 简单查看答案及解析
-
下列有关物质的性质和应用均正确的是
A.NH3能氧化氮氧化物,可用于汽车尾气净化 B.瓷坩埚能耐高温,可用于加热分解石灰石
C.Fe在O2中的燃烧产物可用于制红色涂料 D.Mg (OH)2受热能分解,可用作阻燃剂
难度: 简单查看答案及解析
-
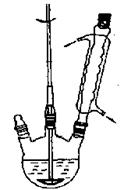
下列实验操作或装置不符合实验要求的是
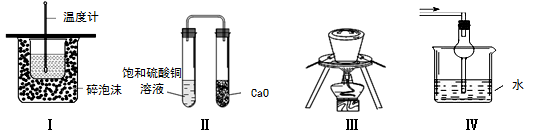
A.装置Ⅰ可用于测定中和热
B.装置Ⅱ久置后,饱和硫酸铜溶液可能析出蓝色晶体
C.装置Ⅲ在海带提碘实验中用于灼烧海带
D.装置Ⅳ可用于吸收易溶于水的尾气
难度: 简单查看答案及解析
-
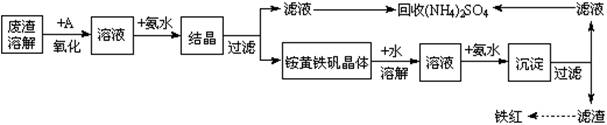
下列各组物质按右图所示转化关系每一步都能一步实现的是
甲
乙
丙
丁
A
FeCl3
FeCl2
Fe2O3
Fe(OH)3
B
Cu
CuO
CuSO4
CuCl2
C
S
SO2
SO3
H2SO4
D
NH3
NO
NO2
HNO3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol碳烯(:CH2)中含有的电子数为6NA
B.3.2 g铜与足量硫加热充分反应,电子转移总数为0.1NA
C.100mL 0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01NA
D.常温常压下,甘油(C3H8O3)和甲苯(C7H8)的混合物46g中含有4NA个氢原子
难度: 简单查看答案及解析
-
能正确解释下列反应原理的离子方程式是
A.用小苏打治疗胃酸过多:CO32- + 2H+ === CO2↑ + H2O
B.向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:
2Al3+ + 3SO42- + 3Ba2+ + 6OH- === 3BaSO4↓ + 2Al(OH)3↓
C.大理石溶于醋酸中:CaCO3 + 2H+ === Ca2+ + CO2↑ + H2O
D.稀硝酸中加入过量的铁粉:Fe + 4H+ + NO3- === Fe2+ + NO↑ + 2H2O
难度: 简单查看答案及解析
-
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式为:Ni2++2e- = Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,电解槽底部的阳极泥中含有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
难度: 简单查看答案及解析
-
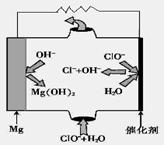
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
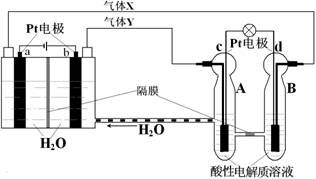
A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
难度: 简单查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍。下列说法不正确的是
A.原子半径大小顺序:Z>W>R
B.对应的氢化物的热稳定性:R>W
C.W与X、W与Z形成的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硫酸,说明红色固体是铜
B.用蒸馏水、酚酞、BaCl2溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为Na2CO3)的纯度
C.取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3
D.用饱和碳酸钠溶液多次洗涤BaCO3,可除去BaCO3中少量的BaSO4,说明Ksp(BaCO3)<Ksp(BaSO4)
难度: 简单查看答案及解析
-
反应CO(g)+2H2(g)
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
组序号
1
2
3
4
反应温度/℃
225
235
225
235
反应前气体的物质的量/mol
CO2
0
0
0.2
0.2
CO
3.0
3.0
2.8
2.8
H2
7.0
7.0
7.0
7.0
平衡时CH3OH的体积分数/%
4.9
8.8
36.5
50.7
A.该反应的△H>0
B.当容器中压强不变时,反应达到平衡
C.CH3OH含量增大的原因是CO2起了催化作用
D.少量CO2能提高平衡时CH3OH的体积分数
难度: 简单查看答案及解析
-
关于下列电解质溶液的说法中,正确的是
A.常温下,10 mL 0.2mol/L NH4NO3溶液与10 mL 0.1mol/L NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH-)>c(H+)
B.0.1 mol/LNa2S溶液中:c(Na+) + c(H+) = c(S2-) + c(HS-) + c(OH-)
C.常温下a mL 0.1 mol/L KOH与b mL 0.1 mol/L HCN两溶液混合后pH>7,则一定有a≥b
D.10 mL 0.1mol/L NaCl溶液中离子总数为x,10mL 0.1mol/LCH3COONa溶液中离子总数为y,则x>y
难度: 简单查看答案及解析