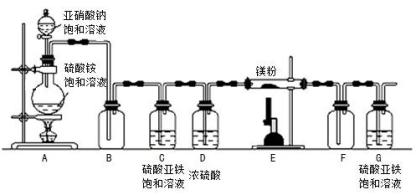
-
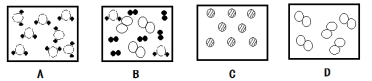
下列图标中,属于塑料包装制品回收标志的是

难度: 简单查看答案及解析
-
下列变化属于化学变化的是
A.石蜡熔化 B.滴水成冰 C.粮食酿酒 D.花香四溢
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A.氢氧根离子:OH- B.铝离子:Al+3
C.两个氮原子:2N2 D.氯化钠:NaCl2
难度: 中等查看答案及解析
-
下列调味品加入适量水后不能形成溶液的是
A.食盐 B.蔗糖 C.豆油 D. 味精
难度: 简单查看答案及解析
-
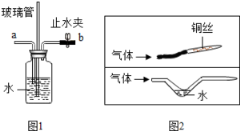
下图是R原子结构示意图和磷元素的相关信息,下列说法错误的是
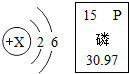
A.X=8
B.磷元素的相对原子质量为15
C.两种元素可形成化学式为P2R5的化合物
D.磷可在R的单质中燃烧
难度: 中等查看答案及解析
-
下列几种常见饮料中,不含有机物的可能是
A.果汁 B.牛奶 C.矿泉水 D.啤酒
难度: 中等查看答案及解析
-
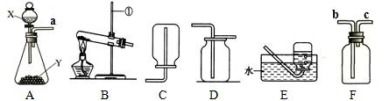
下列实验操作正确的是
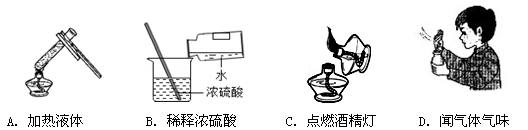
难度: 中等查看答案及解析
-
用分子观点解释“干冰升华”,下列说法错误的是
A.分子不停地运动 B.分子间间隔变大
C.分子体积急剧增大 D.分子本身不发生变化
难度: 中等查看答案及解析
-
根据实践经验,你认为下列“课外实验”不能成功的是
A.用润湿的pH试纸测定不同品牌洗发液的酸碱度
B.用酒精浸泡捣烂的紫罗兰花瓣自制酸碱指示剂
C.用柠檬酸、果汁、白糖、水、小苏打等自制汽水
D.用干电池、灯泡、导线、6B铅笔芯等验证石墨导电性
难度: 中等查看答案及解析
-
磷酸二氢铵(NH4H2PO4)是化肥中的一种,下列说法错误的是
A.磷酸二氢铵是一种复合肥料
B.一个磷酸二氢铵分子由12个原子构成
C.磷酸二氢铵中氮、氢、磷、氧的质量比为1:6:1:4
D.磷酸二氢铵的相对分子质量是115
难度: 中等查看答案及解析
-
用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质质量分数为10%的氯化钠溶液。以下说法中,正确的是
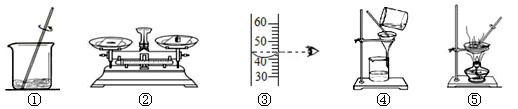
①甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
②甲实验各步操作中,玻璃棒的作用都是相同的
③乙实验若按照②③①的步骤进行操作,则配制溶液的溶质质量分数偏大
④乙实验中,若①所用的烧杯内壁沾有水,则配制溶液的溶质质量分数偏小
A.④ B.③④ C.①④ D.②③④
难度: 中等查看答案及解析
-
下图为硫酸钠和氯化钠的溶解度曲线。下列说法正确的是
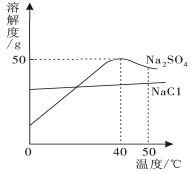
A.温度升高,两种物质的溶解度都增大
B.50℃的Na2SO4饱和溶液降到40℃时有晶体析出
C.40℃时,75g饱和Na2SO4溶液中含25g Na2SO4
D.可用降温结晶的方法提纯含少量Na2SO4的NaCl
难度: 中等查看答案及解析
-
下图为某化工企业生产流程示意图,有关说法正确的是
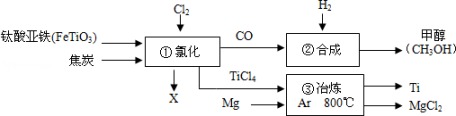
A.③中氩气(Ar)作反应物
B.流程中的一氧化碳、钛酸亚铁和甲醇都是氧化物
C.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为7:1
D.①中反应为2FeTiO3+6C+7Cl2
2x+2TiCl4+6CO,则x为FeCl2
难度: 中等查看答案及解析
-
下列归纳和总结完全正确一组是
A.对鉴别方法的认识
B.对食品健康的认识
①化纤和羊毛——点燃后闻气味
②磷矿粉和氯化铵——观察颜色
③硬水和软水——加肥皂水搅拌
①霉变的大米洗净烧熟后可以食用
②利用甲醛水溶液浸泡水产品防腐
③补充维生素A防止夜盲症
C.对除杂方法的认识
D.对生活常识的认识
①CO2(CO)——点燃
②CaO(CaCO3)——加稀盐酸
③FeCl2(CuCl2)——加入过量的铁粉
①洗涤剂除去油污——乳化作用
②煤炉上放一壶水防止CO中毒——CO能溶于水
③活性炭净化水——吸附性
难度: 简单查看答案及解析
-
有一包白色固体粉末,可能含有CuSO4、BaCl2、Na2SO4、Na2CO3、NaCl中的一种或几种,某同学对其组成进行了探究,过程如下:
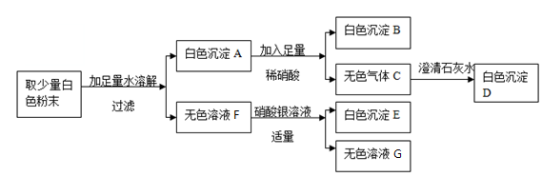
根据以上实验操作与现象,该同学得出的结论不正确的是
A.无色溶液F中只有NaCl
B.沉淀B的化学式为BaSO4
C.原混合物中一定不含CuSO4
D.原混合物中一定含有BaCl2、Na2SO4、Na2CO3
难度: 中等查看答案及解析