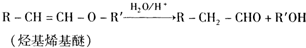
-
河虾与西红柿同时食用会使人中毒,原因是河虾中所含的+5价砷和西红柿中的维生素C反应生成一种含+3价砷的有毒的化合物.下列说法正确的是( )
A.上述反应中维生素C作催化剂
B.上述反应中维生素C作氧化剂
C.由于河虾中含有砷元素,所以不能食用
D.由上述信息推测,有毒的砒霜中的砷可能为+3价难度: 中等查看答案及解析
-
根据相关化学原理,下列推断正确的是( )
A.若晶体A为原子晶体,晶体B为分子晶体,则熔点:B>A
B.若X原子的质子数为a,中子数为b,则X的质量数为:a-b
C.若R2-离子和M+离子的电子层结构相同,则离子的核电荷数:R2-<M+
D.若弱酸HA的酸性强于弱酸HB,则相同条件下同浓度钠盐溶液的pH:NaA>NaB难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.7.8g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键
B.2L0.1mol/L的醋酸钠溶液中,醋酸根离子数为0.2NA
C.5.6g铁与足量的稀硝酸反应,失去电子数为0.2NA
D.碳棒作电极电解CuSO4溶液,当阴极析出3.2g固体时,阳极转移的电子数为0.1NA难度: 中等查看答案及解析
-
在下列给定条件的水溶液中,一定能大量共存的离子组是( )
A.含有大量SiO2-3的溶液:K+、Na+、OH-、Cl-
B.使石蕊变红的溶液:Fe2+、Na+、NO-3、SO2-4
C.含有大量Al3+的溶液:I-、K+、S2-、NO-3
D.使酚酞变红的溶液:Ca2+、NH+4、HCO-3、Cl-难度: 中等查看答案及解析
-
已知甲为恒温恒压容器,乙为恒温恒容容器.两容器中均充入2molSO2、1mol O2,发生反应:2SO2(g)+O2(g)
2SO3(g).初始时两容器的温度、体积相同,一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是( )
A.向乙容器中充入一定量的SO2气体
B.向甲容器中充人一定量的氦气
C.升高乙容器的温度
D.增大甲容器的压强难度: 中等查看答案及解析
-
如图所示,X是铁,Y是石墨,a是饱和食盐水,实验开始前,在U形管的两边各滴入几滴酚酞试液,下列叙述错误的是( )
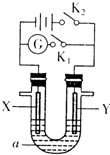
A.合上K1、断开K2,电子由X经导线流向Y
B.合上K2、断开K1,电解一段时间后,Y电极附近溶液呈红色
C.合上K2、断开K1,U形管中发生的反应为:2C1-+2H2OCl2↑+2OH-+H2↑
D.合上K1、断开K2,Y电极反应为:2H2O+O2+4e-=4OH-难度: 中等查看答案及解析
-
下列离子浓度关系正确的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.常温下,0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=c(H+)+2c(Na+)
D.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)难度: 中等查看答案及解析
-
下列实验能达到预期目的是( )
A.实验内容:向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热
实验目的:检验混合物中是否含有甲醛
B.实验内容:向米汤中加入含碘的食盐,观察是否有颜色的变化
实验目的:检验含碘食盐中是否含碘酸钾
C.实验内容:向红砖粉末中加入盐酸,充分反应后,取上层清液于试管中,滴加硫氰化钾溶液,观察溶液颜色的变化
实验目的:检验红砖中是否含有+3价铁
D.实验内容:向淀粉溶液中加入稀硫酸,加热后,再做银镜反应实验
实验目的:检验淀粉是否水解难度: 中等查看答案及解析