-
已知反应CO(g)=C(s)+O2(g)的△H为正值,△S为负值.设△H和△S不随温度改变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行
D.任何温度下都不能自发进行难度: 中等查看答案及解析
-
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极难度: 中等查看答案及解析
-
已知反应A2(g)+2B2(g)⇌2AB2(g)(正反应放热),下列说法正确的( )
A.升高温度,正向反应速率减小,逆向反应速率增加
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动难度: 中等查看答案及解析
-
控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极难度: 中等查看答案及解析
-
已知:298K时,2SO2(g)+O2(g)⇌2SO3(g);△H=-Q1KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是( )
A.无法比较
B.Q1<Q2
C.Q1=Q2
D.Q1>Q2难度: 中等查看答案及解析
-
据报道,锌电池可能取代目前广泛应用的铅蓄电池,因为锌电池容量更大,而且没有铅污染.其电池反应为:2Zn+02=2ZnO,原料为锌粒、电解质和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-=Zn2+
C.正极发生氧化反应
D.电解液肯定是强酸难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为“0.8mol/”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)═2HF(g)△H=-270kJ,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量难度: 中等查看答案及解析
-
压强变化不会使下列化学反应的平衡发生移动的是( )
A.C(s)+CO2(g)⇌2CO(g)
B.3H2(g)+N2(g)⇌2NH3(g)
C.2SO2(g)+O2(g)⇌2SO3(g)
D.H2(g)+I2(g)⇌2HI(g)难度: 中等查看答案及解析
-
下列变化过程,属于吸热反应的是( )
(1)液氨汽化
(2)将胆矾加热变为白色粉末
(3)浓硫酸稀释
(4)氨催化氧化生成一氧化氮
(5)酸碱中和生成水
(6)FeCl3溶于水显酸性.
A.(1)(2)(6)
B.(1)(2)(4)(6)
C.(2)(6)
D.(2)(4)(6)难度: 中等查看答案及解析
-
以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.银质奖牌(纯银制成)久置后表面变暗
C.铁质器件附有铜质配件,在接触处易生铁锈
D.生铁比纯铁芯(几乎是纯铁)容易生锈难度: 中等查看答案及解析
-
如图所示装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
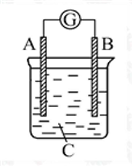
A.A是Zn,B是Cu,C为稀H2SO4
B.A是Cu,B是Zn,C为稀H2SO4
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液难度: 中等查看答案及解析
-
在2A(g)+B(g)⇌3C(g)+4D(g)中,表示该反应速率最快的是( )
A.υ(A)=0.5mol/
B.υ(B)=0.3mol/
C.υ(C)=0.8mol/
D.υ(D)=1mol/难度: 中等查看答案及解析
-
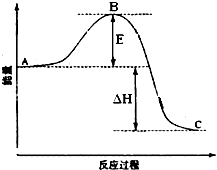
在一定条件下A与B反应可生成C和D,其能量变化如图:
下列有关反应A+B═C+D的说法正确的是( )
A.反应前后原子的种类和数目一定不变
B.反应前后分子的种类和数目一定改变
C.反应物的总能量E1与生成物的总能量E2一定相等
D.此反应一定有热量的变化难度: 中等查看答案及解析
-
如图是温度和压强对X+Y⇌2Z 反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )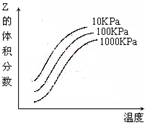
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的正反应的△H>0难度: 中等查看答案及解析
-
把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)⇌nZ(g)+2W(g).5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/L•min,则n的值为( )
A.4
B.3
C.2
D.1难度: 中等查看答案及解析
-
在2L的密闭容器中,发生3A(g)+B(g)⇌2C(g)的反应,若最初加入A和B都是4mol,10s后,测得υ(A)=0.12mol•L-1•S-1,则此时容器中B的物质的量是( )
A.1.6mol
B.2.8mol
C.3.2mol
D.3.6mol难度: 中等查看答案及解析
-
可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列各关系中能说明反应已达到平衡状态的是( )
A.2υ正(H2)=3υ逆(NH3)
B.υ正(N2)=υ逆(NH3)
C.3υ正(N2)=υ正(H2)
D.υ正(N2)=3υ逆(H2)难度: 中等查看答案及解析
-
某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)⇌C(g)+D(g),当下列物理量不发生变化时:
①混合气体的密度
②容器内气体的压强
③混合气体的平均相对分子质量
④B的物质的量浓度
则能表明该反应一定已达到平衡状态的是( )
A.只有④
B.②③
C.②③④
D.①③④难度: 中等查看答案及解析
-
电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液.电池总反应式为:Zn+Ag2O=ZnO+2Ag,下列说法错误的是( )
A.该电池的正极是Zn,负极是Ag2O
B.该电池负极的电极反应式为:Zn+2OH=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池工作时,电解质中的阴离子向负极移动难度: 中等查看答案及解析