-
化学是在原子、分子水平上研究物质的:①组成;②结构;③性质;④变化;⑤制备;⑥应用的重要自然科学。你认为其中正确的是
A.只有③④ B.只有①⑤ c.只有②⑤⑥ D.全部
难度: 简单查看答案及解析
-
下列说法正确的是
A.10%的食盐溶液是指l00 克水中溶解了10克食盐
B.某物质只含有一种元素,则该物质不可能是混合物
C.聚乙烯是一种无毒的天然高分子化合物,可以用于食品包装
D.生铁和钢是含碳量不同的铁的两种合金
难度: 简单查看答案及解析
-
下列因果关系不正确的是

难度: 简单查看答案及解析
-
生活中处处离不开化学,下列做法有利于身体健康的是
A.用着色剂将馒头染色
B.人体每日必须摄入足够量的钙
c.端午节时用CuSO4溶液浸泡粽叶,使粽叶变得鲜绿
D.自来水中通人大量Cl2进行杀菌消毒
难度: 简单查看答案及解析
-
分类是学习和研究中一种常用的科学方法,下列分类不正确的是
A.纯碱、烧碱均属碱类
B.甲烷、乙醇、葡萄糖均属于有机物
C.盐酸、硫酸、硝酸均属酸类
D.糖类、油脂、蛋白质均属于营养素
难度: 简单查看答案及解析
-
进行化学实验,观测实验现象,通过分析推理得出正确结论是化学学习的方法之一。对下列实验事实的解释正确的是
A.高锰酸钾受热后,固体质量减少了,说明化学反应前后各物质的质量总和不相等
B.在某化肥中加入碱液,无氨味,说明该化肥一定不是氮肥
C.把铁钉放在硫酸铜溶液中,铁钉上有紫红色的铜生成,说明铁比铜活泼
D.在紫色的石蕊溶液中通入二氧化碳气体,溶液变红,说明二氧化碳气体显酸性
难度: 简单查看答案及解析
-
理科课程的目标是提高学生的科学素养,从而满足学生终身学习和发展的需求。你认为下列观点不正确的是
A.元素、单质、纯净物都是宏观范畴,分子、原子、离子是微观范畴
B.世界是物质的,物质都是看的见、摸的着的
C.树立珍惜资源、爱护环境、合理使用化学物质的观念
D.物质的结构决定性质,性质决定用途;反之用途反映性质,性质反映结构
难度: 简单查看答案及解析
-
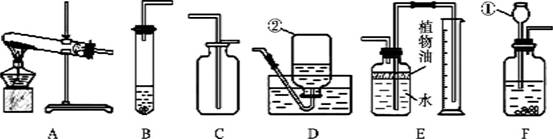
下列各图所示装置的气密性检验中,漏气的是
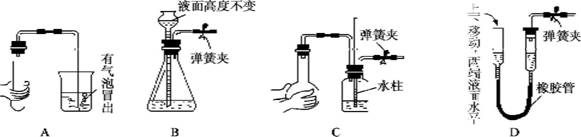
难度: 简单查看答案及解析