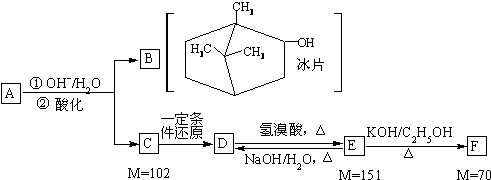
-
下列叙述正确的是( )
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降难度: 中等查看答案及解析
-
25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大难度: 中等查看答案及解析
-
化学与生活密切相关,下列有关说法正确的是( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.糖类、蛋白质、油脂都属于天然高分子化合物
C.煤经气化和液化两个物理变化过程,可变为清洁能源
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料难度: 中等查看答案及解析
-
下列实验设计和结论相符的是( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液难度: 中等查看答案及解析
-
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2⇌O2+HbCO,37℃时,该反应的平衡常数K=220.HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损.据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动难度: 中等查看答案及解析
-
已知:
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.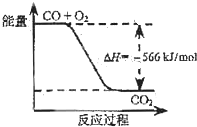
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023难度: 中等查看答案及解析