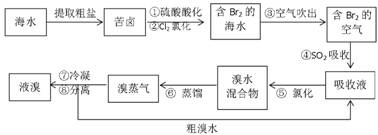
-
下列叙述正确的是
A.
和
的质量数相同,中子数不同
B.
和
的质子数相同,是同一种核素
C.Na和K属于I A族元素,Na的金属性比K强
D.Cl和Br属于VII A族元素,两原子核外电子数之差为8
难度: 简单查看答案及解析
-
下列有关化工生产的说法正确的是
A.将氯气通入澄清石灰水制取漂白粉
B.电解饱和食盐水溶液制取金属钠
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓H2SO4吸收SO3,目的是防止形成酸雾,使SO3吸收完全
难度: 简单查看答案及解析
-
下列事实的解释正确的是
A.浓H2SO4和浓盐酸混合可制HCl气体,是利用了浓H2SO4的强酸性
B.SO2使溴水褪色,是利用了SO2的漂白性
C.将SO2、SO3混合气体通入氯化钡溶液中,出现浑浊,是因为有BaSO4生成
D.反应“CuSO4+H2S = CuS↓+H2SO4”能进行,是利用了较强酸制较弱酸的原理
难度: 简单查看答案及解析
-
现有钠、镁、铝各1mol,分别与100mL 5.0mol/L盐酸充分反应后,所得同温、同
压下的H2体积关系正确的是
A.产生H2体积相等 B.铝产生H2最多,钠产生H2最少
C.钠产生H2最多,铝产生H2最少 D.钠产生H2最多,镁、铝产生H2相等
难度: 简单查看答案及解析
-
在测定卤素互化物BrF3(液态)电导时,发现20℃时导电性很强,说明该化合物在液态时发生了电离,存在阴、阳离子。其它众多实验证实,存在一系列有明显离子化合物倾向的盐类,如:KBrF4、(BrF2)2SnF6等。由此推断液态BrF3电离时的阴、阳离子的组成最合理的是
A.Br3+和F— B.BrF2+和BrF4— C.BrF2—和F— D.BrF52—和BrF2+
难度: 简单查看答案及解析
-
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
A.1:3 B.2:3 C.3:1 D.4:3
难度: 简单查看答案及解析
-
下列有机物可通过氧化、酯化、加聚三种反应制备高聚物
的是
A.CH3—CH2—CH2—OH B.
C.
D.
难度: 简单查看答案及解析
-
A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是
A.A和M原子的电子总数之和可能为11 B.A和M的原子序数之差为8
C.A和M原子的最外层电子数之和为8 D.A和M原子的最外层电子数之差为7
难度: 简单查看答案及解析
-
下列说法错误的是
A.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
B.氮的固定只有在高温、高压、催化剂的条件下才能实现
C.硅胶疏松多孔,可用作催化剂的载体
D.高纯度的硅单质广泛用于制作光导纤维
难度: 简单查看答案及解析
-
设nA 代表阿伏加德罗常数的数值,下列说法正确的是
A.5.6g铁粉与足量水蒸气反应生成的H2分子数为0.10nA
B.1mol Mg与足量O2或N2反应生成MgO或Mg3N2失去的电子数为2nA
C.46 g NO2 和 N2O4混合气体中含有原子数为3nA
C.1L 1mol·L-1醋酸溶液中离子总数为2nA
难度: 简单查看答案及解析
-
在下列条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、SO32―、I-、MnO4-
B.在水电离出的c(H+)=1×10-3mol·L-1的溶液中:K+、Fe3+ 、ClO-、Fe2+
C.c(HCO3-)=0.1 mol·L-1的溶液中:Na+、K+、CO32-、Br-
D.含有大量NO3-的水溶液中:NH4+、K+、SO42-、H+
难度: 简单查看答案及解析
-
短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A.原子半径B>C>A B.氧化物的熔点B>A
C.A与C能形成离子化合物 D.氢化物的稳定性C>A
难度: 简单查看答案及解析