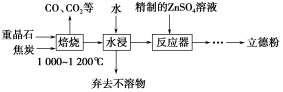
-
下列实验操作对实验结果不产生影响的是
A. 用酸碱中和滴定法测定未知浓度的碱液时,加入甲基橙或酚酞1~2 mL
B. 用托盘天平称量4.2 g NaCl时,左盘放砝码,右盘放NaCl
C. 用pH试纸测定90 ℃时纯水的pH
D. 配制一定物质的量浓度的溶液时,容量瓶用蒸馏水洗净后未干燥
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32—+2H+
CO2↑+H2O
B.用惰性电极电解饱和食盐水:2Cl-+2H+
H2↑+Cl2↑
C.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:2Fe2++4Br-+3Cl2
2Fe3++6Cl-+2Br2
D.饱和Ca(OH)2溶液中加入少量NaHCO3溶液:Ca2++OH-+HCO3—
CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列说法都正确的是
A.某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,说明原溶液中一定含SO42—
B.将含有SO2杂质的CO2气体,缓慢通过足量的高锰酸钾溶液,再通过浓硫酸干燥,可获得较纯净的CO2气体
C.某钠盐(含NaHCO3、Na2CO3中的一种或两种)试样0.168 g,将其灼烧,冷却,并用托盘天平称量残留固体的质量,根据质量是否变化,可确定样品的组成
D.铝热反应可生成铁,工业上可大量利用该反应来生产铁
难度: 中等查看答案及解析
-
某强碱性溶液中含有的离子是:K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验: ①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;②另取一定量原溶液,逐滴加人盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。③另取一定量的原溶液中加人5 mL0.2 mol/L盐酸时,沉淀会完全消失,加人足量的硝酸银溶液可得到沉淀0.187 g。下列说法中正确的是
A.该溶液中一定不含NH4+、A13+、SiO32-、Cl-
B.该溶液中一定含有A13+、CO32-、Cl-
C.Cl-可能含有
D.该溶液中一定含有AlO2-、CO32-、Cl-
难度: 困难查看答案及解析
-
将17.9 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36 L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72 L NO(标准状况),向反应后的溶液中加人过量NaOH溶液,得到沉淀的质量为
A.33.2 g B.25.4 g C.22.4 g D.19.6 g
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
分别加热Na2CO3和NaHCO3固体
试管内壁均有水珠
两种物质均受热分解
B
加热盛有NH4Cl固体的试管
试管底部固体消失,试管口有晶体凝结
NH4Cl固体可以升华
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置
溶液上层呈橙红色
Br—还原性强于Cl—
D
向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液
加入H2O2后溶液变成血红色
Fe2+既有氧化性又有还原性
难度: 困难查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水
A.①② B.②③ C.①④ D.④⑤
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是

A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置检验装置的气密性
D.图④是实验室洗涤胶头滴管的操作
难度: 中等查看答案及解析
-
对实验Ⅰ~Ⅳ的实验现象预测正确的是
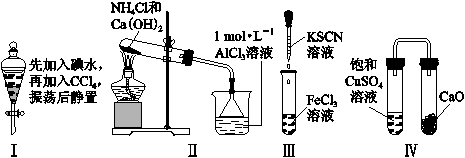
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中立刻出现红色沉淀
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
难度: 中等查看答案及解析
-
将磁性氧化铁放入稀HNO3中发生反应:3Fe3O4+ 28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3 在反应中只作氧化剂
D.磁性氧化铁中的铁元素全部被氧化
难度: 中等查看答案及解析
-
著名化学家、诺贝尔奖获得者西博格博士1979年在美国化学会成立100周年大会上的讲话中指出“化学是人类进步的关键”。下列对化学的认识不正确的是
A.英国科学家道尔顿1661年提出化学元素的概念,标志着近代化学的诞生
B.化学是在原子、分子水平上认识物质的组成、结构、性质、变化、制备和应用的自然科学
C.化学既是一门具有创造性的科学,还是一门具有实用性的科学
D.现代化学还将在能源与资源、材料科学、环境科学、医药与健康等领域产生广泛的影响
难度: 简单查看答案及解析
-
卢瑟福发现铀产生的a、b、c三种射线在电场中有如图所示情况。下列认识错误的是
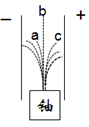
A. c射线是带负电荷的电子流
B. b射线是不显电性的波长很短的电磁波
C. a射线是氦原子——α粒子
D. 在科学家的不懈努力下人类打开了原子结构的大门
难度: 简单查看答案及解析
-
氨水的碱性较弱,其原因是( )
A.它能使酚酞试液变红色
B.氨水极易挥发出氨
C.氨与水结合生成的一水合氨(NH3·H2O)只有小部分电离成NH4+和OH—
D.溶于水的氨大部分以NH3分子形式存在
难度: 简单查看答案及解析
-
如右图所示的铜锌原电池中,铜电极为
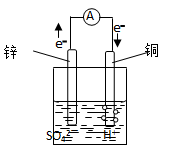
A.负极 B.正极
C.发生还原反应的一极 D.发生氧化反应的一极
难度: 简单查看答案及解析
-
A,B两种有机物,最简式均为CH2O,关于它们的叙述正确的是( )
A. 它们一定是同系物
B. 它们一定是同分异构体
C. 含C,H,O百分数一定相同
D. 等质量的A,B燃烧时耗氧量一定相同
难度: 中等查看答案及解析
-
IT产业中一些车间要求必须做到无尘生产,工人在车间工作时的服装需经静电除尘处理。这种处理方法应用的原理是
A.胶体的丁达尔现象 B.胶体的布朗运动
C.胶体的电泳 D.渗析
难度: 简单查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol·L-1 Na2S溶液中一定有:c(OH-)= c(H+)+ c(HS-)+2c(H2S)
B.向 NH4Cl溶液中加入适量氨水,得到的碱性混合溶液中一定有 :c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.加热Na2S溶液,溶液c(OH-)肯定增大,c(H+)肯定减小
D.加水稀释0.1mol·L-1醋酸溶液,电离平衡向右移动,c(H+)一定减小
难度: 困难查看答案及解析
-
含磷洗涤剂主要是添加了三聚磷酸钠,禁止使用含磷洗涤剂的原因是
A.会引起白色污染
B.会使水生植物大量繁殖,水质变坏
C.会使水中形成沉淀堵塞下水管道
D.价格昂贵,使用成本高
难度: 简单查看答案及解析
-
下列实验能达到预期目的是
A.用乙醇萃取碘水中的碘
B.用通入适量O2并点燃的方法除去CO2中混有的少量CO杂质
C.向煮沸的1 mol•L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D.向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
B.一定温度下,1L0.50mol/LNH4NO3溶液中含氮原子个数为NA
C.过氧化氢分解制得标准状况下1.12LO2,转移电子数目为0.2NA
D.28g分子式为CnH2n的链烃中含有的C-H键的数目为2NA
难度: 中等查看答案及解析
-
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
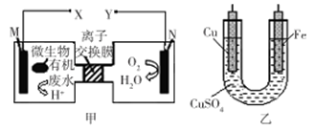
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n + 7nH2O-24ne-= 6nCO2↑ + 24nH+
D.当N电极消耗0.25 mol气体时,则铁电极增重16 g
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.自然界中所有金属都以化合态形式存在
B.化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低
C.废旧金属处理的最好办法是深埋
D.冶炼金属的一般步骤是:浮选富集→冶炼→精炼
难度: 中等查看答案及解析
-
①溴水 ②银氨溶液 ③石灰水 ④氯水 ⑤氢硫酸
⑥NaOH溶液 ⑦FeSO4溶液 ⑧FeCl3溶液 ⑨CuSO4溶液 ⑩醋酸
A. ②③④⑧⑨ B. ⑤⑦⑧⑨⑩ C. ②③④⑤⑦ D. ①⑥⑧
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.在硫化氢水溶液中加入碱有利于S2-的生成
B.加入催化剂有利于氨的氧化反应
C.高压有利于合成氨反应
D.向新制氯水中加入碳酸钙有利于次氯酸浓度增大
难度: 简单查看答案及解析
-
花青苷是引起花果呈现颜色的一种花色素,广泛存在于植物中。它的主要结构在不同pH条件下有以下存在形式:
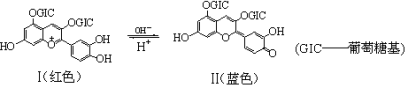
下列有关花青苷说法不正确的是
A.花青苷可作为一种酸碱指示剂
B.I和II中均含有二个苯环
C.I和II中除了葡萄糖基中碳原子外,其它所有碳原子一定共平面
D.I和II均能与FeCl3溶液发生显色反应
难度: 中等查看答案及解析
-
NM3和D 58是正处于临床试验阶段的小分子抗癌药物,结构如下:
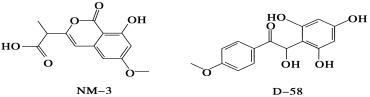
关于NM3和D58的叙述,错误的是
A.都能与NaOH溶液反应,原因不完全相同
B.都能与溴水反应,原因不完全相同
C.都不能发生消去反应,原因相同
D.遇FeCl3溶液都显色,原因相同
难度: 中等查看答案及解析
-
下列对有机物结构或性质的描述,错误的是
A. 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
B. 光照下2,2—二甲基丙烷与Br2反应其一溴取代物只有一种
难度: 简单查看答案及解析
-
在一密闭容器中盛有2molNa2O2与2molNaHCO3,将其加热到150℃,经充分反应后,容器内残留的固体是( )
A.1molNa2CO3和2molNaOH B.2molNa2CO3和2molNaOH
C.2molNa2CO3和1molNa2O2 D.只有2molNa2CO3
难度: 中等查看答案及解析
-
常温下,向100 mL 0.l mol.L-lHCl的溶液中逐滴加入0. 2 mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计)。下列说法中正确的是( )
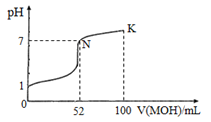
A.MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.在K点,c(M+)>c(Cl-)>c(OH-)>c(H+)
D.K点对应的溶液中,有c( MOH) +c( M+)=0.2 mol.L-1
难度: 困难查看答案及解析
-
向100mL pH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
A.0.02mol B.0.08mol C.0.10mol D.0.16mol
难度: 困难查看答案及解析