-
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ② 生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
A.①②③④ B.②③⑤⑦⑧ C.⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
下列过程需要通电后才能进行的是( )
①电离;②电解;③电镀;④电化学腐蚀
A.①②③ B.②④ C. ②③ D.全部
难度: 简单查看答案及解析
-
关于溶液的酸碱性说法正确的是 ( )
A.c(H+)很小的溶液一定呈碱性
B.PH=7的溶液一定呈中性
C.不能使酚酞试液变红的溶液一定呈酸性
D.c(OH-)= C(H+)的溶液一定呈中性
难度: 中等查看答案及解析
-
下列有关实验原理、方法和结论都正确的是( )
A.用HN02溶液作导电性实验,灯光较暗,说明HN02是弱电解质
B.在滴有酚酞的Na2C03溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2C03溶液中存在水解平衡
C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大
D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来
难度: 中等查看答案及解析
-
下列离子方程式中不正确的是( )
A.氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O
B.铜片接电源正极,碳,棒接电源负极,电解硫酸溶液Cu+2H+
Cu2++H2↑
C.磷酸一氢钠溶液水【解析】
HPO42—+H2OPO43-+H3O+
D.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀: Fe3++3ClO—+3H2O=Fe(OH)3↓+3HClO
难度: 中等查看答案及解析
-
在10mL pH=12的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是( )
A.0.01mol/L CH3COOH B.0.01mol/L HNO3
C.pH=2的H2SO4溶液 D.pH=2的CH3COOH溶液
难度: 中等查看答案及解析
-
已知可逆反应:M(g)+N(g)
P(g)+Q(g) △H>0 。反应达到平衡后,若要增大M的转化率,在其它条件不变的情况下可以采取的措施为( )
①加入一定量的M ②加入一定量的N ③升高反应体系的温度 ④缩小容器体积
⑤加入某物质作催化剂 ⑥分离出一定量的P
A.① ③ ⑤ B.② ④ ⑥ C.② ③ ⑥ D.④ ⑤ ⑥
难度: 中等查看答案及解析
-
25°C时,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是( )
A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加人少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变
难度: 中等查看答案及解析
-
下列各组离子在指定条件下,能够大量共存的是( )
A.滴加KSCN溶液后变成血红色的溶液中:K+、SO42―、Mg2+、H+
B.由水电离出的c(H+)=1×10-11mol/L的无色溶液中:Al3+、Cu2+、NO3―、SO42―
C.能使淀粉KI试纸变蓝的无色溶液中:Na+、S2―、K+、Br―
D.能使蓝色石蕊试纸变红的溶液中:K+、Na+、AlO2―、HCO3―
难度: 中等查看答案及解析
-
控制适宜条件,将反应Sn(s)+Pb2+ (aq)
Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )

A.此时化学反应达到平衡状态
B.若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小
C.若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极
D.若此时升高温度,c(Sn2+)将减小,Pb电极为负极
难度: 中等查看答案及解析
-
在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A,1 mol B,发生反应:2A(g)+B
3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
A.用C的浓度变化表示该反应速率为2.4 mol/(L·min)
B.若使容器变为1 L,则C的物质的量一定增大
C.达到平衡,测得放出热量为x kJ,则x=Q
D.若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态
难度: 中等查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe。有关该电池的下列叙述中,正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-=2Li++FeS
难度: 中等查看答案及解析
-
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列
有关说法正确的是( )
A.除去工业废水中的Cu2+可以选用FeS作沉淀剂
B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生
D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L
难度: 中等查看答案及解析
-
下列有关溶液中粒子浓度的关系式中,正确的是( )
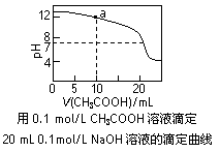
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
难度: 困难查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
则下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ/mol
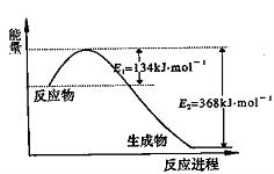
B.反应①中的能量变化如图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
难度: 中等查看答案及解析
-
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?)
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )

A.物质Z的化学计量数a = 2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
难度: 困难查看答案及解析