-
关于吸热反应的说法,正确的是( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.吸热反应一定不能自发进行
D.盐类的水解反应是吸热反应
难度: 简单查看答案及解析
-
常温下,下列各组离子能大量共存的是
A. pH=12的溶液中:K+、Na+、Br-、
B. 无色溶液中:H+、K+、
、
C. c(Fe3+)=0.1mol·L-1的溶液中:K+、H+、SCN-、I-
D. 由水电离出的c(OH-)=1.0×10-13mol·L-1的溶液中:Na+、
、
、
难度: 中等查看答案及解析
-
常温下,下列事实能说明HClO是弱电解质的是
A. 0.01 mol·L-1的HClO溶液pH>2
B. NaClO、HClO都易溶于水
C. NaClO的电离方程式:NaClO=Na++ClO-
D. HClO与Na2SO3溶液反应,可以得到Na2SO4
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A. 活化分子间的碰撞一定是有效碰撞
B. 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加
C. 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据
D. 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10﹣7mol/L
难度: 中等查看答案及解析
-
下列水解反应的应用,不正确的是
A. 热的纯碱溶液清洗油污:
B. 明矾净水:
C. 用TiCl4制备Ti02:
D. 配制氯化亚锡溶液时应加入氢氧化钠:
难度: 中等查看答案及解析
-
下列情况与平衡移动无关的是
A. CaCO3难溶于水,但易溶于盐酸溶液
B. 升温能使醋酸溶液中c(H+)增大
C. 用KClO3制O2时常加入少量MnO2
D. 在NaHS溶液中加入NaOH固体能使c(S2-)增大
难度: 中等查看答案及解析
-
一定条件下,容积为1L的密闭容器中发生反应:
∆H=+148.9kJ·mol-1,下列各项中不能说明该反应已达化学平衡状态的是
A. v(SiF4)消耗=4v(HF)生成 B. HF的体积分数不再变化
C. 容器内气体压强不再变化 D. 容器内气体的总质量不再变化
难度: 中等查看答案及解析
-
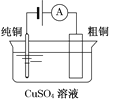
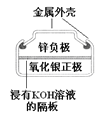
有关下列四个常用电化学装置的叙述中,正确的是
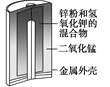

图Ⅰ碱性锌锰电池
图Ⅱ铅-硫酸蓄电池
图Ⅲ电解精炼铜
图Ⅳ银锌纽扣电池
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
难度: 中等查看答案及解析
-
常温下,1mol化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是
共价键
H—H
F—F
H—F
H—Cl
H—I
E(kJ·mol-1)
436
157
568
432
298
A. 432kJ·mol-1>E(H—Br)>298kJ·mol-1
B. 表中最稳定的共价键是H—F键
C. H2(g)→2H(g) ∆H=+436kJ·mol-1
D. H2(g)+F2(g)===2HF(g) ∆H=-25kJ·mol-1
难度: 中等查看答案及解析
-
在一定温度下,向2L体积固定的密闭容器中加入1molHI,
∆H>0,H2的物质的量随时间的变化如图所示,下列说法正确的是
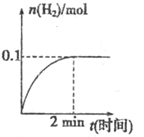
A. 该温度下,恒容时充入HI气体,HI的百分含量增大
B. 0~2min内的HI的平均反应速率为0.05mol·L-1·min-1
C. 恒压下向该体系中加入N2,平衡不移动,反应速率不变
D. 升高温度,平衡向正反应方向移动,只有正反应速率加快
难度: 中等查看答案及解析
-
室温下,下列有关两种溶液的说法不正确的是
序号
①
②
pH
12
12
溶液
氨水
氢氧化钠溶液
A. ①溶液的物质的量浓度为0.01mol·L-1
B. ①②两溶液中c(OH-)相等
C. ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D. 等体积的①②两溶液分别与0.01mol·L-1的盐酸完全中和,消耗盐酸体积:①>②
难度: 中等查看答案及解析
-
为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:①
∆H=+180.50kJ·mol-1
②
∆H=-905.48kJ·mol-1
则反应
的∆H为
A. +2.98kJ·mol-1 B. -2.98kJ·mol-1
C. +1807.98kJmol-1 D. -1807.98kJ·mol-1
难度: 中等查看答案及解析
-
已知某酸H2B在水溶液中存在下列关系:①
②
,关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
A. NaHB属于弱电解质
B. 溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C. c(Na+)=c(HB-)+c(B2-)+c(H2B)
D. c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:
,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
D. 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
难度: 中等查看答案及解析
-
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A. 过滤后的溶液中一定没有S2-
B. MnS难溶于水,可溶于MnCl2溶液中
C. 常温时,CuS、PbS、CdS比MnS更难溶
D. 加入MnS后生成CuS的离子方程式是Cu2+ + S2-= CuS↓
难度: 中等查看答案及解析
-
用氢氧燃料电池电解苦卤水(苦卤水含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b均为石墨电极),下列有关说法正确的是
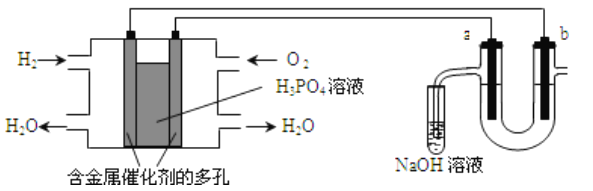
A. 燃料电池工作时,正极反应为:O2+4H++2e-===2H2O
B. 电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极
C. 忽略能量损耗,当电池中消耗1.12LO2(标准状况)时,b极周围会产生0.1gH2
D. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
难度: 中等查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸迸行滴定
B. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C. 将NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水后进行滴定
D. 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
难度: 中等查看答案及解析
-
在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:
∆H=-213.5kJ/mol,达到平衡时的数据如下:
温度/℃
n(活性炭)/mol
n(CO2)/mol
T1
0.70
——
T2
——
0.25
下列说法不正确的是
A. 上述信息可推知:T12
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
难度: 中等查看答案及解析
-
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
A. 正极反应式:Ag+Cl--e-===AgCl
B. 每生成1 mol Na2Mn5O10转移2 mol电子
C. Na+不断向“水”电池的负极移动
D. AgCl是还原产物
难度: 中等查看答案及解析
-
某同学为完成2HCl+2Ag===2AgCl+H2↑反应,设计了下列西个实验。你认为可行的是
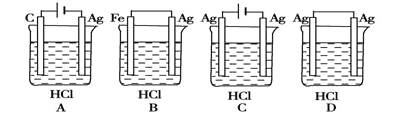
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是
实验
现象
解释或结论
A
加入足量Fe粉
溶液颜色变浅绿色
2Fe3++Fe===3Fe2+
B
加入等体积水
溶液颜色变浅
c(Fe3+)变小
C
加入FeCl3固体
溶液变成红褐色
FeCl3的水解程度变大
D
将FeCl3溶液微热
溶液变成红褐色
水解反应∆H>0
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:
,下列分析不正确的是
A. 浊液中存在沉淀溶解平衡:
B. 实验可以证明NH3结合Ag+能力比Cl-强
C. 实验表明实验室可用氨水洗涤银镜反应后的试管
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
难度: 中等查看答案及解析
-
在通风橱中进行下列实验:
步骤
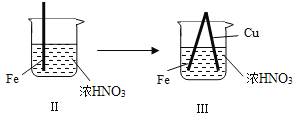
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下:
溶质
Na2CO3
NaHCO3
NaClO
NaHSO3
pH
11.6
9.7
10.3
5.2
下列说法不正确的是
A. 四种溶液中,Na2CO3溶液中水的电离程度最大
B. NaHSO3溶液显酸性的原因是:电离程度大于水解程度
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3
D. 向氯水中加入少量Na2CO3(s),可以增大氯水中次氯酸的浓度
难度: 中等查看答案及解析
-
某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:
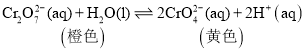 ∆H=+13.8kJ·mol-1
∆H=+13.8kJ·mol-1步骤:
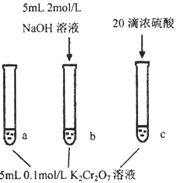
现象:
待试管b中颜色不变后与试管a比较,溶液颜色变浅。
滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深。
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使
完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
难度: 中等查看答案及解析