-
下列设备工作时,将化学能转化为热能的是( )
A B C D 



硅太阳能电池 锂离子电池 太阳能集热器 燃气灶
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A.水中的钢闸门连接电源的负极
B.金属护拦表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块难度: 中等查看答案及解析
-
下列解释事实的方程式不准确的是( )
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.碳酸钠溶液显碱性:CO32-+H2O⇌HCO-3+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O难度: 中等查看答案及解析
-
用石墨电极电解CuCl2溶液(如图).下列分析正确的是( )
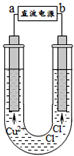
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体难度: 中等查看答案及解析
-
实验:
①0.1mol•L-1AgNO3溶液和0.1mol•L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1mol•L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1mol•L-1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是( )
A.
将NO2球浸泡在冷水和热水中
B.
t/℃
25
50
100
KW/10-14
1.01
5.47
55.0
C.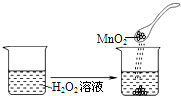
D.
C(氨水)/
0.1
0.01
pH
11.1
10.6难度: 中等查看答案及解析
-
用如图所示装置检验乙烯时不需要除杂的是( )
乙烯的制备 试剂X 试剂Y A CH3CH2Br与NaOH乙醇溶液共热 水 KMnO4酸性溶液 B CH3CH2Br与NaOH乙醇溶液共热 水 Br2的CCl4溶液 C C2H5OH与浓H2SO4加热至170℃ NaOH溶液 KMnO4酸性溶液 D C2H5OH与浓H2SO4加热至170℃ NaOH溶液 Br2的CCl4溶液 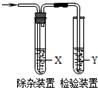
A.A
B.B
C.C
D.D难度: 中等查看答案及解析