-
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为( )
A. 0.1 mol B. 0.2 mol C. 0.3 mol D. 0.4 mol
难度: 简单查看答案及解析
-
用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
难度: 中等查看答案及解析
-
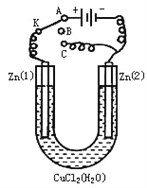
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是附表中的( )

a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:A(g) +B(g)
xC(g);△H = Q。在不同的温度和压强下,C在反应混合物中的含量随反应时间的变化如图所示。下列判断正确的是

A. P1>P2,x=1 B. P1<P2,x≠1
C. T1<T2,Q>0 D. T1>T2,Q<0
难度: 中等查看答案及解析
-
已知反应
,A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是
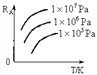
A. 正反应吸热,
B. 正反应吸热,
C. 正反应放热,
D. 正反应放热,
难度: 中等查看答案及解析
-
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)
2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
A. 平衡向正方向移动 B. 平衡不发生移动
C. C的体积分数减小 D. C的体积分数不变
难度: 简单查看答案及解析
-
某温度下,C和H2O(g)在密闭容器里发生下列反应:
①C(s)+H2O(g)
CO(g)+H2(g), ②CO(g)+H2O(g)
CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1。则下列叙述正确的有
A. CO在平衡时转化率为10%
B. 平衡浓度c(CO2)=c(H2)
C. 平衡时气体平均相对分子质量约为23.3
D. 其他条件不变时,缩小体积,H2O(g)的转化率随之降低
难度: 简单查看答案及解析