-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液.
A.②④⑥
B.①②
C.②③⑤
D.②④⑤⑥难度: 中等查看答案及解析
-
可逆反应:2NO2⇌2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时,生成2n mol NO;
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态.
A.①④⑥
B.②③⑤
C.①③④
D.①②③④⑤⑥难度: 中等查看答案及解析
-
等物质的量浓度的下列溶液中,NH4+的浓度最大的是( )
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.NH4NO3难度: 中等查看答案及解析
-
在反应:2A+B⇌3C+4D中,所表示的反应速率最快的是( )
A.v(A)=0.4mol•L-1•s-1
B.v(B)=0.3mol•L-1•s-1
C.v(C)=1.2mol•L-1•s-1
D.v(D)=0.8mol•L-1•s-1难度: 中等查看答案及解析
-
下列是4位同学在学习“化学反应的速率和化学平衡“一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品难度: 中等查看答案及解析
-
下列物质属于非电解质的是( )
A.NH3
B.(NH4)2SO4
C.Cl2
D.CH3COOH难度: 中等查看答案及解析
-
某同学在实验报告中写有以下实验数据:①用托盘天平称取11.7g食盐;②用量筒量取5.26mL的盐酸;③用广泛pH试纸测得某酸溶液的pH值是3.3;④滴定盐酸时用去23.00mLNaOH溶液,其中数据合理的是( )
A.①②
B.③④
C.①④
D.①③④难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3mol/L
B.Y2为0.4mol/L
C.X2为0.2mol/L
D.Z为0.4mol/L难度: 中等查看答案及解析
-
反应3Fe(s)+4H2O(g)⇌Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.保持体积不变,增加H2O(g)的量
B.将容器的体积缩小一半
C.保持体积不变,充入Ne使体系压强增大
D.压强不变,充入Ne使容器的体积增大难度: 中等查看答案及解析
-
对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是( )
A.加入一种反应物
B.对平衡体系加压
C.升高温度
D.使用催化剂难度: 中等查看答案及解析
-
已知反应A2(g)+2B2(g)⇌2AB2(g)(正反应放热),下列说法正确的( )
A.升高温度,正向反应速率减小,逆向反应速率增加
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动难度: 中等查看答案及解析
-
在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3
N2+3H2,达平衡时,N2的物质的量分数为a%,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a%的是( )
A.6molH2和2molN2
B.2molNH3和1molN2
C.2molN2和3molH2
D.0.1molNH3、0.95molN2、2.85molH2难度: 中等查看答案及解析
-
将0.1mol•L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大难度: 中等查看答案及解析
-
含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为Va、Vb,则两者的关系正确的是( )
A.Va>10Vb
B.Va=10Vb
C.Vb<10Va
D.Vb>10Va难度: 中等查看答案及解析
-
下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7;
②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;
④常温下0.1mol/L的HF溶液的pH为2.3;
⑤HF能与Na2CO3溶液反应,产生CO2气体;
⑥HF与水能以任意比混溶;
⑦1mol/L的HF水溶液能使紫色石蕊试液变红.
A.①②⑦
B.②③⑤
C.③④⑥
D.①④难度: 中等查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L难度: 中等查看答案及解析
-
室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
①0.1mol/L的盐酸和0.1mol/L的氨水溶液
②0.1mol/L的醋酸和0.1mol/L的氢氧化钠溶液
③pH=4的盐酸和pH=10的氨水
④pH=4的醋酸溶液和pH=10的氢氧化钠溶液.
A.①③
B.②④
C.②③
D.①④难度: 中等查看答案及解析
-
25℃四种水溶液①HCl,②FeCl3,③KOH,④Na2CO3其 PH值依次为4、4、10、10,而溶液中水的电离程度大小关系正确的是( )
A.①=②=③=④
B.①>③>②>④
C.④=②>③=①
D.①=③>②=④难度: 中等查看答案及解析
-
温度一定时,于密闭容器中发生可逆反应:mA(气)+nB(气)
pC(气),达到平衡后,若将混合气体的体积压缩到原来的
,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9 倍,则下列叙述中正确的是( )
A.平衡向逆反应方向移动
B.C气体的体积分数增大
C.气体A的转化率升高
D.m+n>p难度: 中等查看答案及解析
-
草酸是二元弱酸,KHC2O4溶液呈酸性.对于0.1mol/L KHC2O4,下列关系正确的是( )
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1mol/L
C.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
D.c(C2O42-)<c(H2C2O4)难度: 中等查看答案及解析
-
用0.1mol.L-1NaOH溶液滴定0.1mol.L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL〕.继续加水至50mL,所得溶液的pH是( )
A.4
B.7.2
C.10
D.11.3难度: 中等查看答案及解析
-
下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4-
B.H2SO3的电离方程式:H2SO3=2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O=H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3=Ca2++CO32-难度: 中等查看答案及解析
-
下列各组离子在指定环境中一定大量共存的是( )
A.在c(HCO3-)=0.1mol/L的溶液中:NH4+、Cl-、Al3+、NO3-
B.在pH=13的溶液中:K+、SO32-、S2-、Na+
C.在由水电离出的c(H+)=1×10-13mol/L的溶液中:Fe3+、Cl-、Na+、SO42-
D.在pH=1的溶液中:NO3-、SO42-、Fe2+、Na+难度: 中等查看答案及解析
-
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为( )
A.11:1
B.10:1
C.6:1
D.5:1难度: 中等查看答案及解析
-
可用右侧示意图表示的是( )
反应 纵坐标 甲 乙 A 等质量钾、钠分别与水反应 H2质量 钠
钾B 相同质量氨,在同一容器中2NH3⇌N2+3H2 氨气的转化率 400℃ 500℃ C 体积比1:1的CO、H2O,在恒压容器中,CO+H2O⇌CO2+H2 CO2的浓度 活性高的催化剂 活性一般的催化剂 D 2molO2与1molO2,在相同温度下
2SO2+O2⇌2SO3SO3的物质的量 105Pa 2×105Pa 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
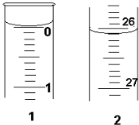 则起始读数为______mL,终点读数为______mL;所用盐酸溶液的体积为______ mL.
则起始读数为______mL,终点读数为______mL;所用盐酸溶液的体积为______ mL.