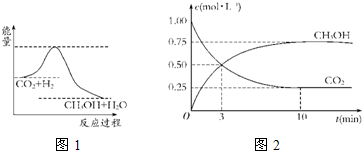
-
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.Na2SO4
B.H2SO4
C.AgNO3
D.NaOH难度: 中等查看答案及解析
-
温度不变时,向饱和BaSO4溶液中加水,下列叙述正确的是( )
A.BaSO4的溶解度不变,Ksp不变
B.BaSO4的溶解度减小,Ksp增大
C.BaSO4的溶解度不变,Ksp增大
D.BaSO4的溶解度增大,Ksp不变难度: 中等查看答案及解析
-
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列正确的是( )
A.①④②③⑥⑤
B.④①②⑥⑤③
C.①④②⑥③⑤
D.④①②③⑥⑤难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.任何化学反应都伴随着能量的变化
B.1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热
C.在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热
D.热化学方程式未注明温度和压强时,△H表示标准状况下的数据难度: 中等查看答案及解析
-
下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒难度: 中等查看答案及解析
-
参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
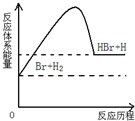
A.正反应为吸热反应
B.正反应为放热反应
C.加入催化剂,该化学反应的能量变化增大
D.从图中可以看出,该反应的能量变化与反应途径有关难度: 中等查看答案及解析
-
下列有关反应限度的叙述正确的是( )
A.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B.依据焓判据:NH4HCO3受热分解可自发进行
C.大多数化学反应在一定条件下都有一定的限度
D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深难度: 中等查看答案及解析
-
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L-1.下列判断错误的是( )
A.x=1
B.2min内A的反应速率为0.3mol•-1
C.该反应达到平衡状态时A的物质的量与总物质的量之比为2:5
D.若混合气体的压强不变,则表明该反应已达到平衡状态难度: 中等查看答案及解析
-
某温度下,反应H2(g)+I2(g)⇌2HI(g)的正反应为放热反应,在带有活塞的密闭容器中达到平衡.下列说法中正确的是( )
A.体积不变,升温,正反应速率减小
B.温度、压强均不变,充入HI气体,开始时正反应速率增大
C.温度不变,压缩气体的体积,平衡不移动,颜色加深
D.体积、温度不变,充入氮气后,正反应速率将增大难度: 中等查看答案及解析
-
经一定时间后,可逆反应aA+bB⇌cC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( )
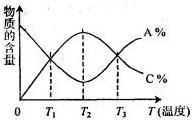
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动难度: 中等查看答案及解析
-
某温度下,C和水在密闭容器中发生下列反应:C(s)+H2O(g)⇌CO(g)+H2(g),CO(g)+H2O(g)⇌CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为( )
A.0.1 mol/L
B.0.9 mol/L
C.1.8 mol/L
D.1.9 mol/L难度: 中等查看答案及解析
-
有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol•L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同难度: 中等查看答案及解析
-
关于浓度均为0.1mol•L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是( )
A.c(CH3COO-):③>①
B.水电离出的c(OH-):②>①
C.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH)
D.①和③等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.在原电池的正极和电解池的阳极上发生的都是氧化反应
B.实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为2:1
C.用铜作电极电解稀硫酸,可能发生反应:Cu+H2SO4CuSO4+H2↑
D.在用惰性电极电解稀硫酸的过程中,溶液pH保持不变难度: 中等查看答案及解析
-
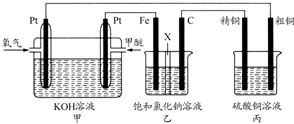
有关如图所示装置的叙述不正确的是( )
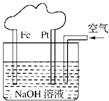
A.这是一个原电池装置
B.该装置中Pt为正极,电极反应为:O2+2H2O+4e-═4OH-
C.该装置中Fe为负极,电极反应为:Fe-2e-+2OH-═Fe(OH)2
D.这是电解NaOH溶液的装置难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
A.①
B.④
C.②③④
D.①②③难度: 中等查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-═Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g难度: 中等查看答案及解析
-
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是( )
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液难度: 中等查看答案及解析
-
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
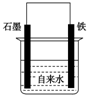
A.正极的电极方程式为:O2+2H2O+4e-═4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快难度: 中等查看答案及解析
-
中和滴定是一种操作简单,准确度高的定量分析方法.实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是( )
A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:KMnO4--紫红色
B.利用“Ag++SCN-═AgSCN↓”原理,可用标准KSCN溶液测量AgNO3溶液浓度:Fe(NO3)3--红色
C.利用“2Fe3++2I-═I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量:淀粉--蓝色
D.利用OH-+H+═H2O来测量某盐酸溶液的浓度时:酚酞--浅红色难度: 中等查看答案及解析